
Contoh Reaksi Perubahan Entalpi Pembakaran Standar Gambaran
Kalor yang dihasilkan pada pembakaran 4,48 liter gas karbon pada keadaan standar sesuai reaksi: C (g). Contoh soal perubahan entalpi nomor 7. Diketahui entalpi pembentukan gas etanol (C 2 H 5 OH), gas CO 2, dan H 2 O berturut-turut adalah -278 kj/mol,. Contoh soal perubahan entalpi nomor 9. Diketahui ΔH f o (fe 3 O 4) = + 266 kkal dan.

Termokimia Part 3 Menentukan Perubahan Entalpi dengan Entalpi Pembentukan Standar & Energi
Perhatikan contoh soal entalpi pembakaran dan pembahasannya berikut ini supaya kamu lebih paham lagi. Soal No. 1. Pada pembakaran 570 gram isooktana (C 8 H 18 ), salah satu komponen yang ada dalam bensin, pada keadaan standar/STP dibebaskan kalor sebesar 27.500 kJ. Hitunglah besarnya entalpi pembakaran standar dan tulislah persamaan termokimia.

Diketahui beberapa entalpi pembentukan standar (delta Hf)...
Pelajari contoh soal perubahan entalpi pembentukan standar dan pemahaman mendalam mengenai konsep ini. Dengan pemahaman yang kuat tentang perubahan entalpi dan langkah-langkah yang terlibat dalam perhitungan, Anda akan mampu menguasai konsep ini dengan mudah. Temukan berbagai contoh soal yang mencakup berbagai senyawa, termasuk senyawa anorganik dan organik.

Diketahui entalpi pembentukan standar CH4, CO2, dan H2O b...
Perubahan entalpi pembentukan standar adalah pengukuran besarnya energi yang diserap atau dilepas untuk pembentukan 1 mol senyawa dari unsur-unsunya yang paling stabil pada keadaan standar. Contoh.. Contoh Soal. Tentukan entalpi pembakaran standar metanol (Mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air.

Contoh Soal Perubahan Entalpi Netralisasi Standar Amat
Soal No. 24. Soal No. 25. 5.8k. Perubahan entalpi adalah perubahan panas dari suatu reaksi kimia yang terjadi pada suhu dan tekanan yang tetap. Perubahan entalpi juga dapat dikatakan sebagai selisih antara entalpi produk dengan entalpi reaktan. Sehingga perubahan entalpi hanya bergantung pada keadaan awal dan keadaan akhir.

Diketahui data entalpi pembentukan standar berikut. C3 H8...
Untuk mencari entalpi pembentukan standar H 2 O (), gunakan persamaan berikut. Jadi, entalpi pembentukan standar untuk H 2 O adalah (x - 2y + z) kJ/mol. Jawaban: A. Contoh soal 6. Perhatikan reaksi berikut. Tentukan besarnya energi ikatan antara atom C dan H! Pembahasan:

Menghitung Entalpi Pembakaran Standar Berdasarkan Data Entalpi Pembentukan Standar (UN Kimia No
Perubahan entalpi pembentukan standar ( ΔH f o) kalor yang dibutuhkan atau dilepas pada peristiwa pembentukan 1 mol senyawa dari unsur-unsur pembentukannya. Contoh. Untuk menyelesaikan soal, umumny akan diberi tahu berap energi ikatan masing-masing molekul jadi kita tidak diharuskan menghafal data energi ikatan.

Diketahui data entalpi pembentukan standar sebagai beriku...
Entalpi Pembentukan Standar. Kalor atau entalpi reaksi dapat ditentukan berdasarkan data entalpi pembentukan standar zat pereaksi dan produknya. Dalam hal ini, zat pereaksi dianggap terurai lebih dulu menjadi unsur-unsurnya kemudian unsur-unsur ini bereaksi membentuk zat produk.

MENGHITUNG PERUBAHAN ENTALPI MENGGUNAKAN DATA PERUBAHAN ENTALPI PEMBENTUKAN STANDAR (TERMOKIMIA
Jenis-jenis Perubahan Entalpi Standar. Ada beberapa jenis perubahan entalpi standar, yaitu: Bernama lain kalor pembentukan standar yang merupakan perubahan entalpi ketika 1 mol senyawa terbentuk dari unsur-unsurnya pada kondisi standar. Persamaan termokimianya adalah: Merupakan perubahan entalpi jika 1 mol suatu zat terbakar sempurna pada.

Diketahui entalpi pembentukan standar (Delta H_(f)/( ))
Entalpi Pembentukan Standar ( ΔH ∘ f) Perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 K, 1 atm). Sebagai contoh entalpi pembentukan standar untuk air adalah − 285 kJ/mol, maka persamaan termokimianya adalah sbb: H2(g) + 1 2O2 → H2O(l) ΔH = − 285 kJ. Yang perlu diperhatikan.

Berikut merupakan data entalpi pembentukan standar. delta...
Contoh Soal Entalpi Pembentukan Standar. Perubahan entalpi (ΔH 0) dipengaruhi suhu dan tekanan yang diukur pada kondisi standar. Kondisi standar yaitu pada tekanan 1 atm dan suhu 25 0 C atau 298 K dengan satuan kJ, sedangkan satuan ΔH molar reaksi adalah kJ/mol. Ada beberapa jenis perubahan entalpi standar berdasarkan jenis reaksi kimia yang.

Diketahui data entalpi pembentukan standar sebagai beriku...
Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Yang perlu diingat dari perubahan entalpi adalah kesesuaiannya dengan hukum kekekalan energi. Seperti dilansir Chemistry Dictionary, terdapat beberapa macam perubahan entalpi standar sebagai berikut : Perubahan.

Contoh Soal Dan Pembahasan Perubahan Entalpi Pembakaran Standar Sexiz Pix
Materi ini bertujuan untuk menentukan perubahan entalpi reaksi berdasarkan data perubahan entalpi pembentukan standar. Diberikan contoh soal yang bisa di gun.

Entalpi Pembentukan Standar Mg2N3 YouTube
Supaya entalpi dapat dihitung, maka pengukurannya harus dilakukan pada suhu serta tekanan tertentu. Perlu diketahui bahwasannya perubahan entalpi pembentukan standar (ΔH o) adalah perubahan entalpi reaksi 1 mol zat pada keadaan yang standar 25 derajat, 1 atm. Dengan kata lain perubahan entalpi yang diukur dengan pengukuran standar akan disebut perubahan entalpi standar.
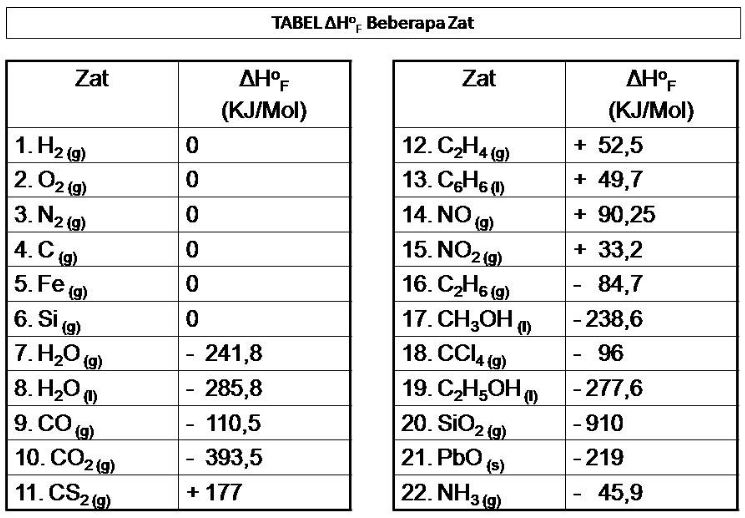
Rumus Perubahan Entalpi Pembentukan Standar Materi Kimia
Contoh perubahan entalpi pembentukan standar dari karbon dioksida.. Contoh soal entalpi fusi. A) Untuk memanaskan 1 kg (1,00 liter) air dari 283,15 K menjadi 303,15 K (10 ° C hingga 30 ° C) membutuhkan 83,6 kJ. Namun, untuk mencairkan es juga membutuhkan energi. Kita dapat memperlakukan kedua proses ini secara independen; dengan demikian.

Contoh Soal Menghitung Entalpi Dari Entalpi Pembentukan Standar Untuk Sma Master Books
Berikut ini pernyataan yang tepat mengenai entalpi pembentukan standar adalah. . 1. Senyawa yang dibentuk harus berjumlah 1 mol. 2. Unsur-unsur pembentuk senyawa harus berjumlah 1 mol. 3. Reaksi pembentukan harus pada suhu ruang. 4. Unsur-unsur pembentuk senyawa harus berwujud gas.