
Sel elektrokimia & Hukum faraday
Pada 1833, Faraday menjelaskan penemuan tentang aspek kuantitatif dari elektrolisis yang akhirnya menghasilkan dua hukum elektrolisis Faraday. Dikutip dari Modul Kimia XII yang disusun oleh Arni Wiyati (2020) dalam hal ini elektrolisis adalah sebuah sel elektrokimia dimana energi listrik digunakan untuk menjalankan reaksi redoks tidak spontan.

K403 RedOks Elektrolisis (Penurunan Rumus Hukum Faraday) YouTube
Baca juga: Pengertian, Prinsip Kerja dan Stoikiometri Sel Elektrolisis. Hukum Faraday I. Bunyi hukum Faraday I adalah: "Massa zat yang dihasilkan pada elektrode selama elektrolisis berbanding lurus dengan jumlah muatan listrik yang mengalir". Artinya, massa produk (W) yang diendapkan pada electrode akan makin banyak seiring dengan.

Pembahasan Soal Elektrolisis Hukum Faraday 1 dan 2 YouTube
Hukum Faraday I. "Massa zat yang dihasilkan pada suatu elektrode selama elektrolisis (G) berbanding lurus dengan jumlah muatan listrik yang digunakan (Q).". Secara matematis, hukum Faraday I dapat ditulis dalam persamaan berikut. Sebagaimana jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus listrik (i) dengan selang waktu (t.

Sel Elektrolisis Part.2 (Hukum Faraday) YouTube
Belajar Hukum Faraday, Ini Pengertian, Bunyi, Rumus, dan Contoh Soalnya. Ilham Pratama Putra • 16 April 2023 19:00. Jakarta: Jika saat ini kamu sedang belajar tentang sel elektrolisis, maka sudah pasti kamu tak asing dengan hukum Faraday. Sebab, hukum ini berkaitan erat dengan sel elektrolisis. Hukum Faraday adalah sebuah hukum yang ditemukan.

ELEKTROKIMIA 2 SEL ELEKTROLISIS, HUKUM FARADAY 1 DAN HUKUM FARADAY 2 YouTube
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Oktober 2, 2023 Oleh Eka, S.Si. Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya. Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Elektrokimia: Sel Elektrolisis dan Hukum Faraday. Oleh Harso Adjie Brotosukmono - 03 Desember. Elektrokimia adalah ilmu kimia yang berkaitan dengan ilmu kelistrikan, Berbagai ilmuwan telah membuktikan bahwa listrik bisa dibangkitkan melalui energi kimia seperti pada baterai dan energi listrik bisa digunakan untuk membantu terjadinya reaksi.

LATIHAN SOAL DAN PEMBAHASAN HUKUM FARADAY II ( SEL ELEKTROLISIS) YouTube
tirto.id - Hukum elektrolisis Faraday 1 dan 2 merupakan hukum yang menyatakan hubungan antara massa zat yang dihasilkan di elektroda dengan muatan listrik yang disuplai pada elektrolisis. Aspek kuantitatif dari sel elektrolisis meliputi massa zat hasil, volume gas hasil, jumlah mol elektron, kuat arus, waktu elektrolisis. Dalam hal ini hukum.

Contoh Soal Sel Elektrolisis
Modul yang berjudul elektrolisis ini akan memberikan pengetahuan pada kalian tentang reaksi-reaksi yang terjadi pada katoda dan anoda pada sel elektrolisis, serta penerapan konsep stoikiometri reaksi redoks dan hukum Faraday.

HUKUM FARADAY 2 SEL ELEKTROLISIS 3 YouTube
Hukum Faraday II menyatakan bahwa "Jumlah zat yang dihasilkan oleh arus yang sama di dalam beberapa sel yang berbeda berbanding lurus dengan berat ekuivalen zat-zat tertentu." Oleh karena itu, jika beberapa sel elektrolisis disusun secara seri atau arus listrik sama (jumlah muatan listrik yang sama juga), maka perbandingan massa zat-zat.

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 2) YouTube
Jelajahi sel elektrolisis dan hukum Faraday, dua konsep yang menyelami rahasia di balik reaksi kimia yang menakjubkan. Pelajari bagaimana sel elektrolisis memungkinkan pemisahan unsur-unsur dengan menggunakan listrik sebagai katalis, serta bagaimana hukum Faraday menentukan kuantitas zat yang dihasilkan dalam reaksi tersebut. Temukan betapa pentingnya penemuan ini dalam dunia industri modern.

Elektrolisis (Reaksi Elektrolisis dan Hukum Faraday) Kimia XII YouTube
Bismillah.Hallo semua, Vidio ini merupakan vidio bagian ke 5 dari materi sel Elektrokimia.Pada vidio ini yang dibahas adalah stoikiometri atau Perhitungan re.
Hukum Faraday Pojok Kimia
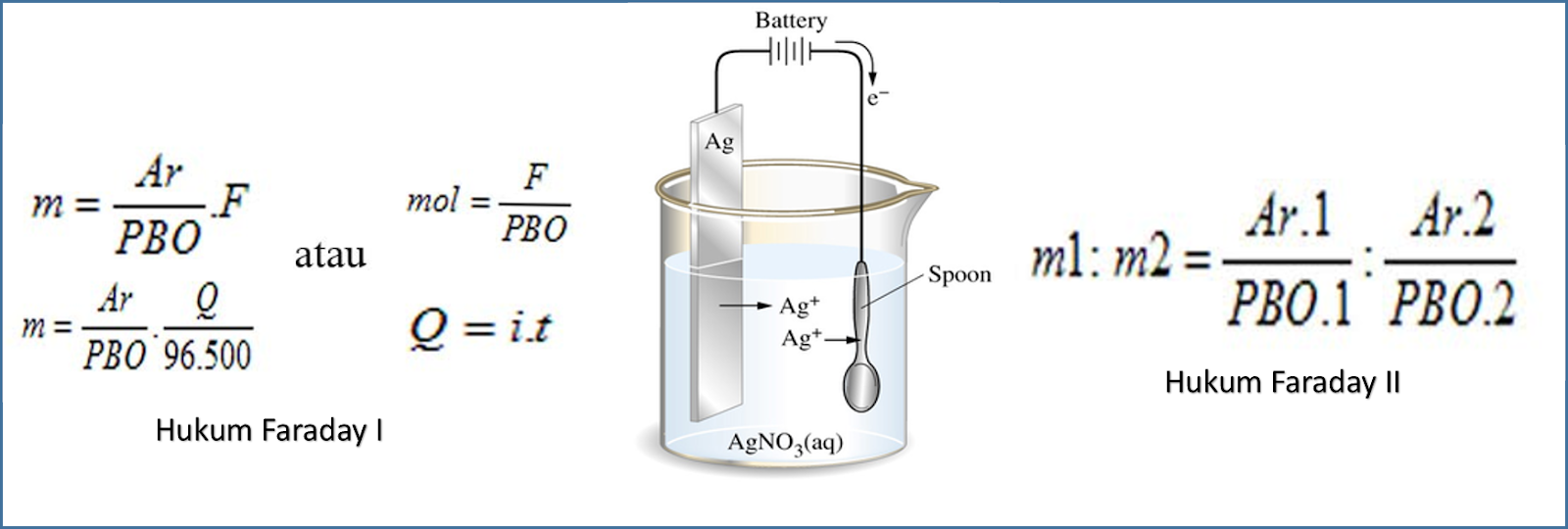
1. Hukum Faraday I. "Massa zat yang terjadi atau melarut selama proses electrolysis berbanding lurus dengan jumlah muatan listrik yang melalui sel elektrolisis kimia". w = eF w = e F. Ket: w = massa zat hasil elektrolisis (gram) e = massa ekuivalen zat hasil electrolysis, e = Ar valensi e = A r v a l e n s i.

Contoh Soal & Pembahasan Elektrolisis & Hukum Faraday Bagian II My Brain
Hukum Faraday: Pengertian, Bunyi, Rumus, dan Contoh Soalnya. by Bob Bastian & Andjar Tyassih, S.Si. April 12, 2023. Quipperian, apakah saat ini kamu sedang belajar tentang sel elektrolisis? Kalau begitu, kamu tentu sudah tidak asing lagi, ya dengan hukum Faraday karena hukum ini berkaitan erat dengan sel elektrolisis.

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 1) YouTube
Hukum Faraday 1. Apa itu Hukum Faraday 1? Jadi, Hukum Faraday 1 itu merupakan massa zat yang dihasilkan pada suatu electrode selama proses elektrolisis berbanding lurus dengan muatan listrik yang digunakan. Kita sudah mengetahui bahwa massa zat (w) yang dihasilkan pada elektrode berbanding lurus dengan jumlah molelektron.

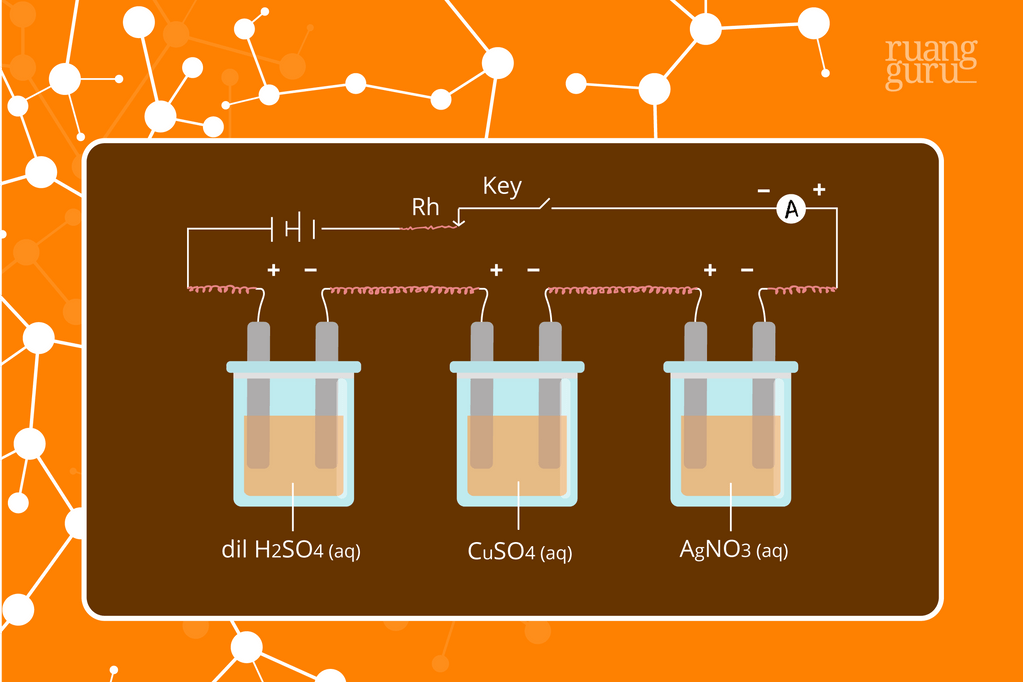
Foto Hukum Faraday I dan II tentang Elektrolisis
Source: Office of the Registrar General and Census Commissioner. Explanation: States and districts in the boundaries of 2023; subdistricts in the boundaries of 2011. Population figures of new delimitated districts and split subdistricts are mostly computed by using subdistricts or villages in the boundaries of 2011.

ELEKTROLISIS Hukum Faraday I dan2, Penentuan massa endapan pada reaksi elektrolisis. YouTube
a. Hukum Faraday I. Hukum ini menyatakan bahwa massa zat yang diendapkan atau dilarutkan sebanding dengan muatan yang dilewatkan dalam sel dan massa ekivalen zat tersebut , dinyatakan dalam rumus: w = e.F. Keterangan: w = massa zat hasil elektrolisis (gram) e = massa ekuivalen zat hasil elektrolisis, e = Ar / valensi.