
Soal Mol Penjelasan Lengkap dan Komprehensif tentang Mol dalam Kimia
Berikut pembahasan lengkap konsep mol yang dikutip dari Buku Pintar Pelajaran: Ringkasan Materi Dan Kunpulan Rumus Lengkap karangan Drs. Joko Untoro (2010:137). Pengertian Mol dan Jumlah Partikel Mol merupakan jumlah tertentu untuk menyatakan banyaknya suatu zat yang berukuran mikroskopis (berukuran kecil).

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Rumus Mol. Tonton video Pengertian Mol serta Hubungan antara Mol dengan Massa Suatu Zat. Gimana biar lebih paham dengan rumus-rumus di atas kita langsung praktekkan aja nih guysss ke contoh soal. Contoh soal 1. Berapa sih volume dari 23 g gas NO₂ yang diukur pada tekanan 1 atm dan suhu 27°C?
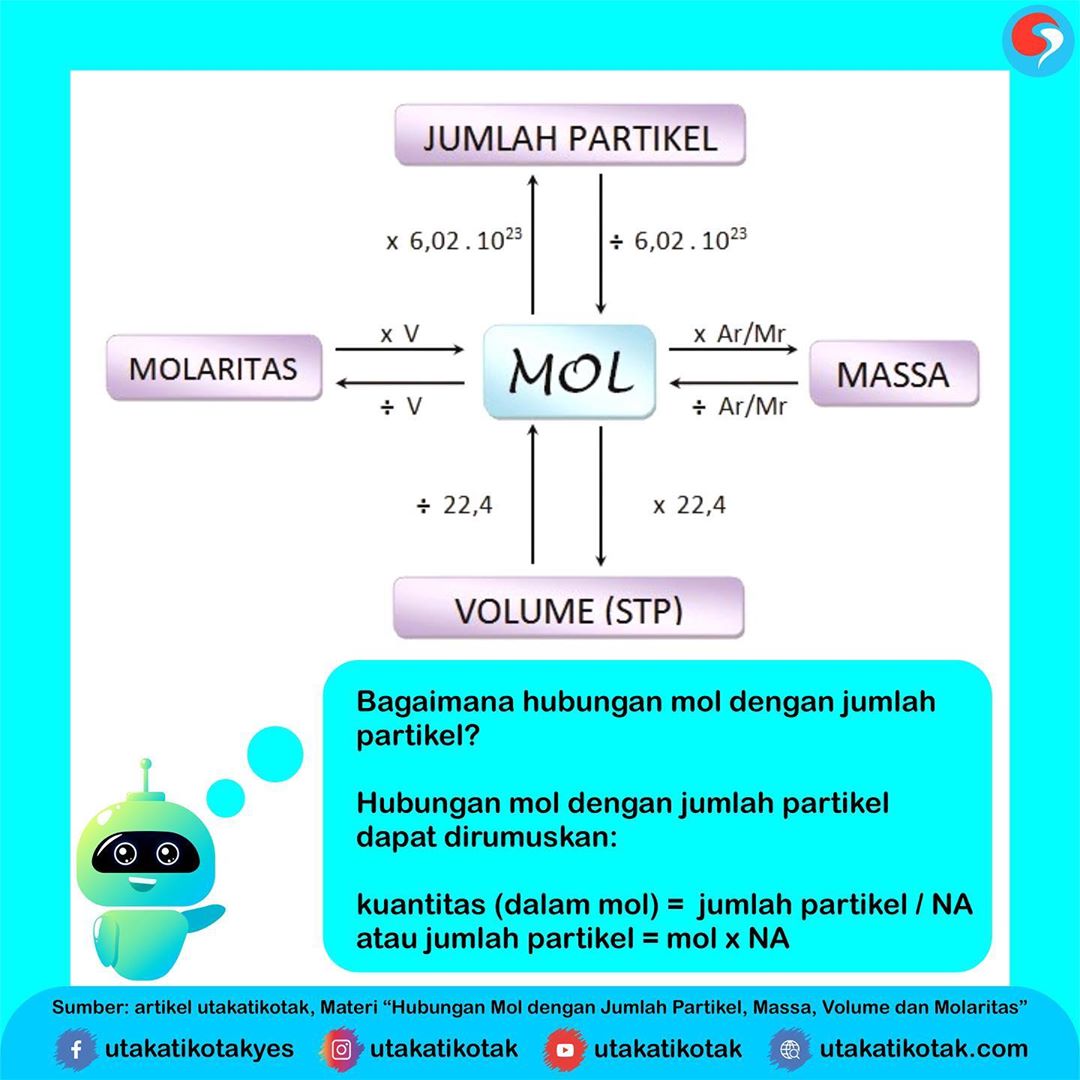
Hubungan Mol dengan Jumlah Partikel, Massa, Volume dan Molaritas
Dikutip dari Buku Pintar Pelajaran Ringkasan Materi dan Kumpulan Rumus Lengkap, Drs. Joko Untoro & Tim Guru Indonesia, (2010: 137) pengertian mol adalah satuan jumlah zat yang dipergunakan dalam perhitungan kimia. Sedangkan satu mol adalah satuan banyaknya partikel atau merupakan penyederhanaan jumlah partikel suatu ion, molekul, atau unsur.
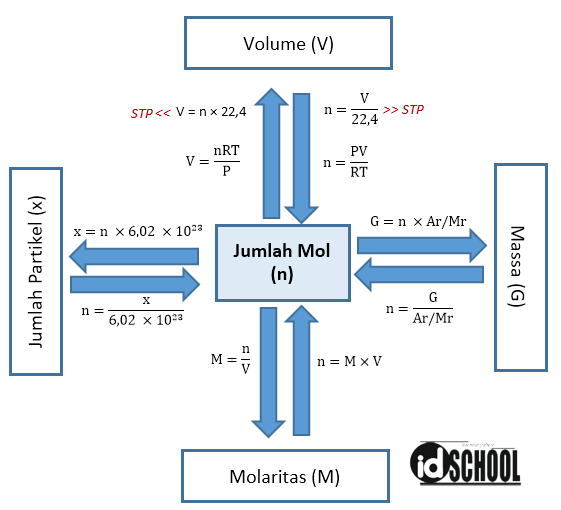
Konsep Mol pada Perhitungan Kimia
Rumus Mol. Jika kamu diminta untuk menentukan mol dari suatu zat yang diketahui massanya, gunakan persamaan berikut. Dengan: n = mol; m = massa zat; dan. Mr = massa molekul relatif. Langkah-Langkah Menentukan Fraksi Mol. Untuk memudahkanmu dalam menentukan fraksi mol, yuk ikuti langkah berikut.
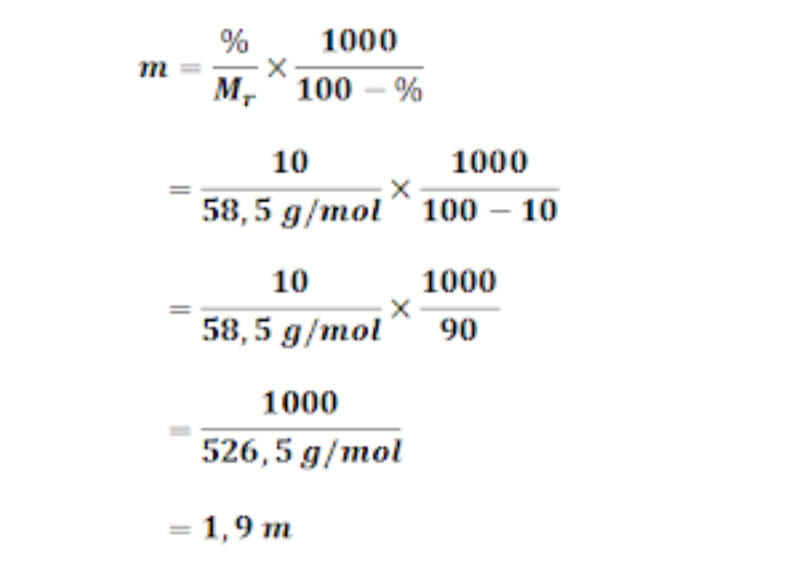
Cara Menghitung dan Contoh Soal Fraksi Mol dan Jawabannya Rumus dan Pembahasan Fraksi Mol
Pengertian rumus molekul adalah rumus yang menyatakan jumlah atom dari unsur-unsur dalam senyawa. Rumus Empiris. Untuk mendapatkan rumus empiris (RE) atau empirical formula, dapat digunakan perhitungan dalam mol unsur menghasilkan perbandingan jumlah atom dalam molekul. Langkah-langkah menentukan rumus empiris suatu senyawa, sebagai berikut:

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah Partikel, Volume Gas, Molaritas
As mass/volume = molarity × molar mass, then mass / (volume × molar mass) = molarity. Substitute the known values to calculate the molarity: molarity = 5 / (1.2 × 36.46) = 0.114 mol/l = 0.114 M. You can also use this molarity calculator to find the mass concentration or molar mass. Simply type in the remaining values and watch it do all the.

Konsep Mol dan Analisanya
Rumus fraksi mol zat pelarut. Zat pelarut adalah suatu zat yang dapat melarutkan bahan lain dan membentuk campuran atau larutan. Biasanya, zat pelarut merupakan zat cair baik yang bersifat polar maupun non polar. Rumus fraksi mol zat pelarut adalah: Dengan, xp: fraksi mol zat pelarut. np: jumlah mol zat pelarut.

Konsep Mol Pada Kimia Rezfoods Resep Masakan Indonesia
Rasio mol adalah perbandingan antara jumlah dalam senyawa yang sebagai faktor konversi. Juga dikenal sebagai: Rasio mol juga disebut rasio mol-ke-mol. Satuan perbandingan mol adalah mol:mol atau bilangan tak berdimensi karena satuannya saling meniadakan. Untuk setiap 1 mol O2 yang. Untuk setiap 2 mol H Jika 4 mol hidrogen digunakan, maka 4 mol air.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Pengertian, Konsep, Rumus Mol. Ilustrasi Pengertian, Konsep, Rumus Mol, Foto: Unsplash/coffeekai. Dikutip dari buku Pendekatan Pembelajaran Sains Berbasis Konstruktivis Ed. Revisi, Srini M. Iskandar (2022: 168), terdapat pengertian, konsep, rumus mol yang perlu diketahui. Jadi, reaksi kimia berlangsung antara partikel-partikel pereaksi dalam.
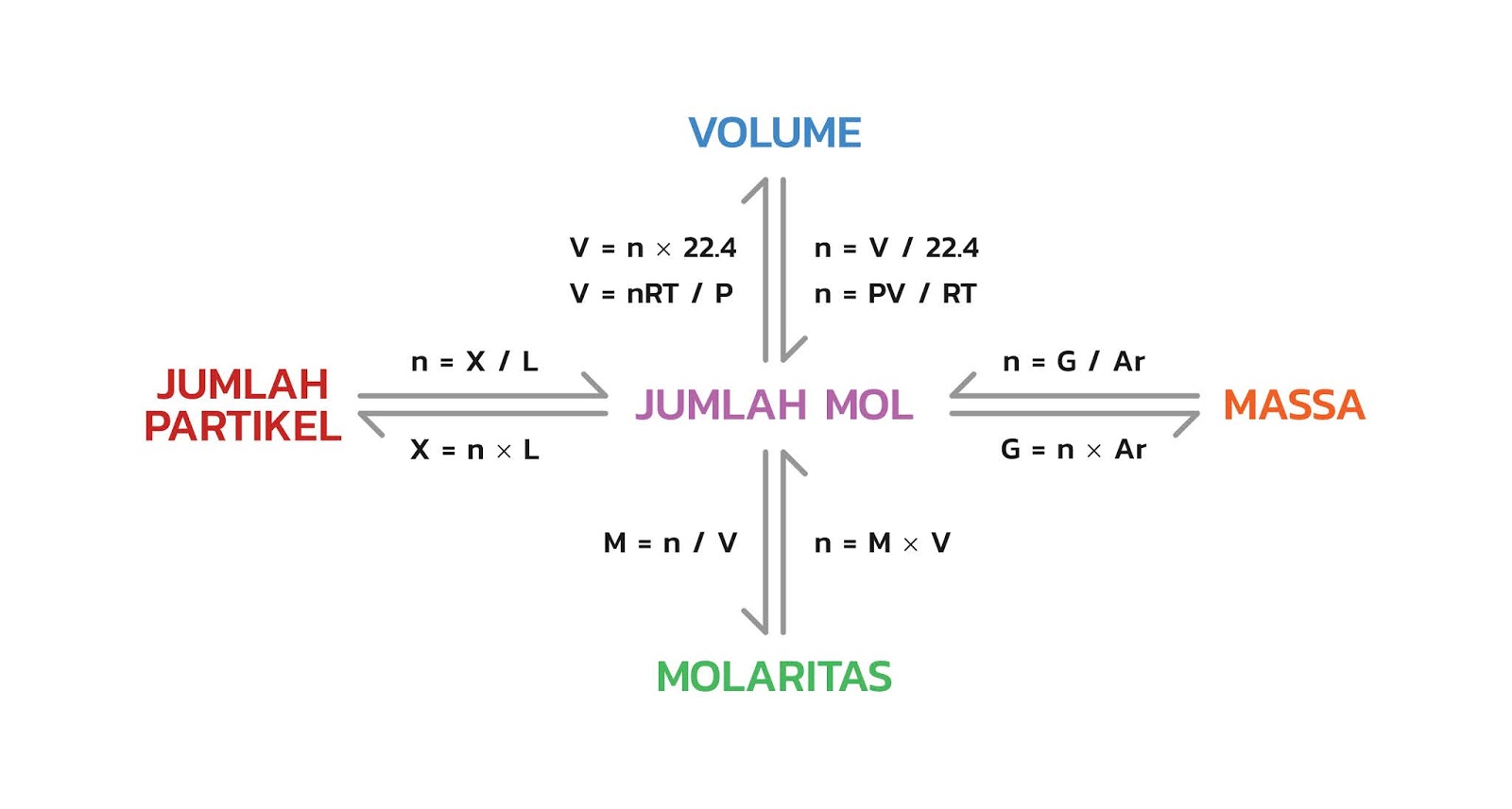
Hubungan Mol Dengan Jumlah Partikel Massa Volume Dan Molaritas Riset
Setelah mempelajari mol & konsep stoikiometri, maka kita telah menguasai dasar-dasar dari salah satu cabang kimia yakni kimia analitik, yang berkutat mengenai jumlah zat dan perubahannya dalam reaksi. Untuk mulai belajar materi & contoh soal Mol & Stoikiometri dan penyelesaiannya kamu bisa langsung klik daftar materi dibawah ini.

PPT KONSEP MOL PowerPoint Presentation, free download ID6336687
In chemistry, a mole is a unit of measurement that is used to express the amount of a substance. The mole is defined as the amount of a substance that contains the same number of particles (atoms, molecules, or ions) as there are in 12 grams of carbon-12.

Belajar Kimia Rumusrumus dasar Konsep Mol YouTube
Contoh penggunaan rumus ini adalah dalam menghitung jumlah molekul air dalam 1 liter air. Kita dapat menghitung berapa mol air yang terkandung dalam 1 liter air, yaitu sekitar 55,5 mol. Dengan menggunakan rumus di atas, kita dapat mengalikan jumlah mol dengan bilangan Avogadro untuk mendapatkan jumlah molekul air, yaitu sekitar 3,34 x 10^25.

Pengertian Mol Konsep dan Penggunaannya dalam Kimia
Rumus Fraksi Mol. Molalitas ialah konsentrasi larutan yang menyatakan jumlah mol, zat terlarut dalam 1 kilogram atau 1000 gram pelarut. rumus molalitas adalah sebagai berikut : Jumlah mol zat pelarut / 1Kg zat pelarut. Fraksi mol zat terlarut (Xt) biasa dirumuskan dirumuskan dengan rumus seperti berikut ini:
PPT STOIKIOMETRI KIMIA PowerPoint Presentation, free download ID4269409
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

KONSEP MOL DAN HUKUM GAS Kimiazainal
n = gram/Mr = 3/60 = 0,05 mol. Setelah diketahui molnya, kita bisa menggunakan rumus molaritas larutan urea. M = n/V = 0,05/0,25 = 0,2 Molar. Jadi, molaritas dari larutan urea adalah 0,2 Molar atau 0,2 mol/liter. Itu dia penjelasan mengenai rumus molaritas dan molalitas suatu larutan dalam Kimia. Masih sering merasa kesulitan belajar materi.

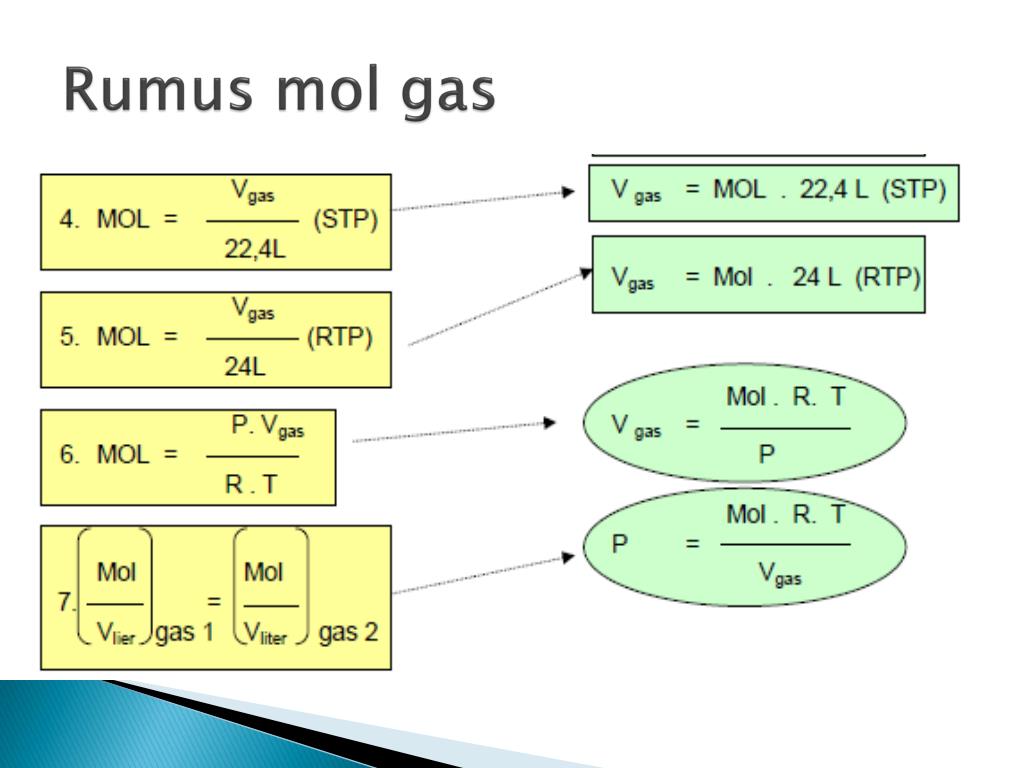
Konsep Rumus Mol 59
Konsep mol Kimia ternyata enggak sesulit yang dibayangkan, lho. Simak penjabaran konsep, pengertian, dan latihan soalnya di sini, yuk. SBMPTN.. Senyawa kimia identik dengan rumus-rumus kimia yang dinyatakan dengan unsur-unsur tertentu, contohnya air (H 2 O), oksigen (O 2), dan glukosa (C 6 H 12 O 6). Setiap unsur penyusun tersebut memiliki.