
Contoh Soal Molaritas Dan Pembahasannya
Rumus normalitas kimia adalah N = n x a /V, yang menyatakan nilai normal (N) yang sama dengan satu mol ekivalen/liter.. Dalam kimia, terdapat beberapa besaran yang dapat digunakan untuk menyatakan suatu konsentrasi zat terlarut dalam sebuah larutan antara lain yaitu molaritas, molalitas, normalitas dan fraksi mol.

Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.

Pengertian Molaritas, Rumus dan Contohnya
Dari contoh soal di atas bisa diketahui volume zat berbentuk mililiter, maka rumus mencari molaritas Mg (OH)2 yang digunakan adalah: M M g (OH) 2 = (7,25 : 58) x (1.000 : 250) = 0,50 M. Contoh 2. Sebanyak 10 gram NaOH (Mr = 40) dilarutkan ke dalam air sehingga volume larutan 2 liter. Tentukan molaritas larutan NaOH tersebut!

Cara mudah menentukan massa zat dari molaritas YouTube
Pengertian Molaritas. Sebelum masuk ke rumus molaritas dan contoh soal, elo harus mengetahui dasarnya dulu tentang apa itu molaritas. Molaritas adalah salah satu ukuran kelarutan yang menyatakan jumlah mol suatu zat per volume larutan. Molaritas ini dilambangkan dengan huruf "M" dengan satuannya molar atau M yang setara dengan mol/liter.

Contoh soal MOLARITAS YouTube
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

Molaritas Pengertian, Rumus, Pembuatan, Pengenceran Larutan Dan Contohnya Lengkap BprsKu.Co.Id
Maka, cara mencari molaritas jika diketahui volume-nya adalah sebagai berikut: M = 0,106/0,125 = 0,85 Jadi, molaritas larutannya yaitu 0,85 M. Itu tadi penjelasan mengenai molaritas yang menggambarkan hubungan antara mol zat terlarut dan volume larutan, beserta rumus molaritas lengkap dengan pembahasan soalnya.

Rumus Mencari Molaritas dari Kadar Larutan (Persentase Kepekatan Zat) YouTube
Terdapat beberapa rumus molaritas yang dapat kita gunakan, tentunya bergantung pada jenis soal yang kita jumpai. 1. Rumus Molaritas Dasar. Rumus molaritas yang paling dasar secara matematis dirumuskan sebagai berikut : M =. n V. Keterangan: M menyatakan Molaritas. Satuan dari Molaritas adalah : mol/liter.

Rumus molaritas molalitas normalitas dan fraksi mol 2021
Keempat, molaritas suatu larutan dapat dengan mudah dihitung menggunakan rumus molaritas M = n / V. Contoh Soal Rumus Molaritas. Contoh 1 : Hitung molaritas NaOH dalam larutan yang dibuat dengan melarutkan 4 gram dalam air yang cukup untuk membentuk 250 mL larutan. Jawaban : Mr NaOH = 40 (23 + 16 + 1) gr = 4 gram V = 250 mL. Sesuai rumus molaritas : M = (gr / Mr) x (1000 / V mL)
Pahami Rumus Molaritas, Contoh Soal, dan Pembahasannya Berikut Ini
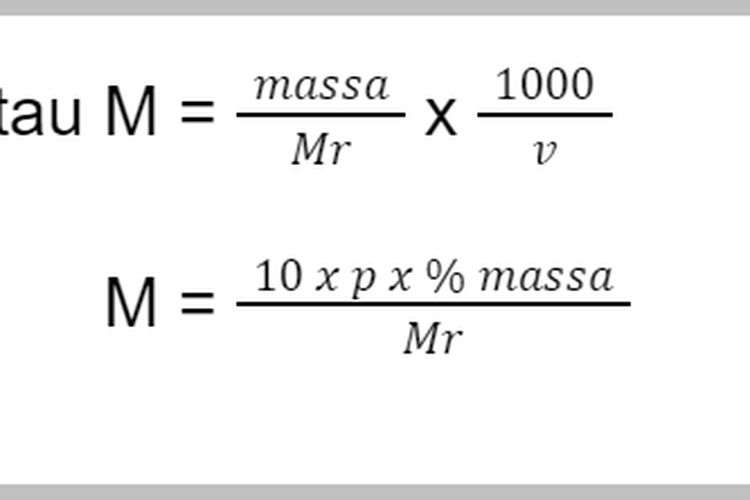
Dilansir dari buku Rumus Lengkap Kimia SMA oleh Anwar Santoso, molaritas menyatakan jumlah mol zat terlarut dalam setiap satu liter larutan. Berikut rumus dasarnya: M = Mol zat terlarut/liter larutan = n/V. Jika volume larutan dinyatakan dalam ml, maka rumus molaritas dapat dinyatakan dengan: M = n x 1000/V. atau.

Rumus Normalitas, Molaritas, Molalitas Pengertian, Rumus, Contoh Soal dan Pembahasan
Rumus, Kimia, Rumus Kimia, Ilmu Kimia, Materi Kimia SMA Kelas 10 11 12, Contoh Soal Kimia dan Penyelesaian, Materi Kimia Kurikulum 2013,. Dalam perhitungan molaritas, kuantitas larutan didasarkan pada volume. Sahabat tentu tahu bahwa volume merupakan fungsi suhu (zat akan memuai ketika dipanaskan).

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Sebuah Molaritas dari larutan NaCl sebesar 0,4 M, pada air sebanyak 40 L. Cobalah untuk menentukan banyaknya mol NaCl yang terlarut dalam air tersebut! Pembahasan: M = n/V. 0,4 mol/liter = n/40 liter. 0,4 mol x 40 = n. n - 40 mol. Jadi, molaritas larutan NaCl pada soal tersebut adalah 16 mol. 3. Berapa molaritas larutan asam sulfat 25% (massa.

Cara Menghitung Normalitas Kimia Rumus Molaritas dan Normalitas Praktikum Kimia Analisis
Rumus molalitas - Ketika duduk di bangku SMA, kita akan berkenalan dengan kimia. Kimia sendiri tidak hanya soal mencampur stau zat dengan zat lain atau ikatan ion saja.. Jika molaritas bergantung pada ukuran liter larutan, molalitas bergantung pada massa larutan. Sehingga, dapat ditarik kesimpulan bahwa molalitas lebih sering digunakan.

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Untuk mencari molaritas, kamu harus menghitung jumlah mol terlarut setiap liter larutan. Mililiter tidak dapat digunakan. Rumus umum yang digunakan untuk mencari molaritas dapat ditulis: molaritas = mol terlarut / liter larutan. Contoh soal: Berapa molaritas larutan yang mengandung 1,2 mol CaCl 2 dalam 2905 mililiter?

apa perbedaan molalitas dan molaritas Brainly.co.id
Perlu diingat bahwa molaritas bergantung pada volume larutan secara keseluruhan dan bukan hanya bergantung pada volume zat pelarut. Rumus molaritas. Untuk menghitung molaritas, kita dapat menggunakan rumus molaritas. Berikut adalah rumus-rumus molaritas! M = g/Mr x 1.000/V atau M = n/V. Dengan, M: molaritas (mol/L) n: jumlah mol zat

Hubungan molaritas, massa jenis larutan dan kadar zat YouTube
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.

Rumus Molaritas Lengkap Contoh Soal, Penjelasan Pembuatan Larutan dan Pengenceran
Contoh perhitungan molaritas larutan. Misalnya 0,25 liter larutan urea (CO(NH2)2) dibuat dengan cara melarutkan 3 gram urea dalam air. Massa molekul relatif urea adalah 60. Molaritas larutan urea bisa dihitung dengan cara : Jumlah mol urea, n = gram/Mr = 3/60 = 0,05 mol Molaritas larutan, M = n/V = 0,05/0,25 = 0,2 molar