
Contoh Soal Hidrolisis Asam Lemah Dan Basa Lemah
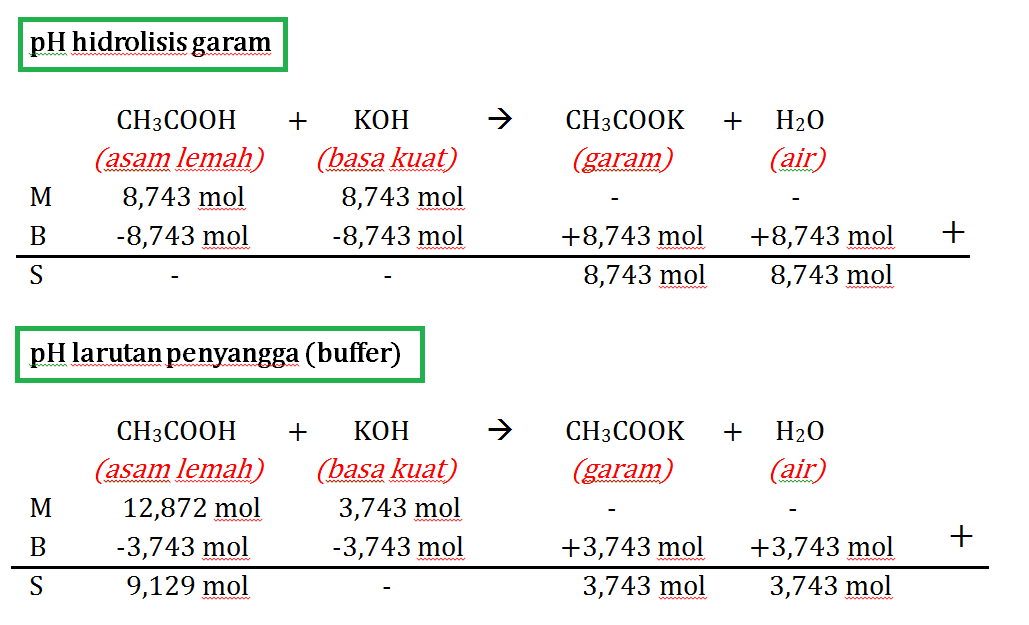
Rumus Hidrolisis Garam. 1. Garam yang terbentuk dari komponen asam lemah dan basa kuat. Garam yang berasal dari asam lemah dan basa kuat dalam air akan mengalami hidrolisis sebagian. Komponen garam (anion asam lemah) mengalami hidrolisis menghasilkan sebuah ion OH -, maka pH > 7 sehingga larutan garam bersifat basa.

Pengertian, Jenis, Rumus dan Contoh Soal Hidrolisis Garam Beserta Jawaban Lengkap
Konsep Hidrolisis. Selamat Datang dan Selamat Belajar di Wardaya College! Di sini, kamu akan belajar tentang Konsep Hidrolisis melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar). Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya.
Rumus Hidrolisis mertqdate
Hidrolisis - Kimia Kelas 11 - Teori, Jenis Reaksi, dan Contoh Soal. by sereliciouz & Andjar Tyassih, S.Si. Agustus 28, 2019. Dalam artikel ini akan dibahas secara detail tentang teori dan reaksi hidrolisis, jenis-jenis reaksi hidrolisis, contoh soal dan pembahasan reaksi hidrolisis, dan aplikasi reaksi hidrolisis dalam kehidupan sehari-hari.

Rumus Hidrolisis Total Pemburu Soal Jawaban
1. Rumus tetapan hidrolisis garam yang berasal dari asam kuat dan basa kuat. Karena perbandingan [H +] dan [OH -] sama, maka larutan bersifat netral sehingga kita tidak memerlukan Kh untuk menghitung pH larutan tersebut, karena sudah dipastikan pH = 7.. 2. Rumus tetapan hidrolisis garam yang berasal dari asam kuat dan basa lemah

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
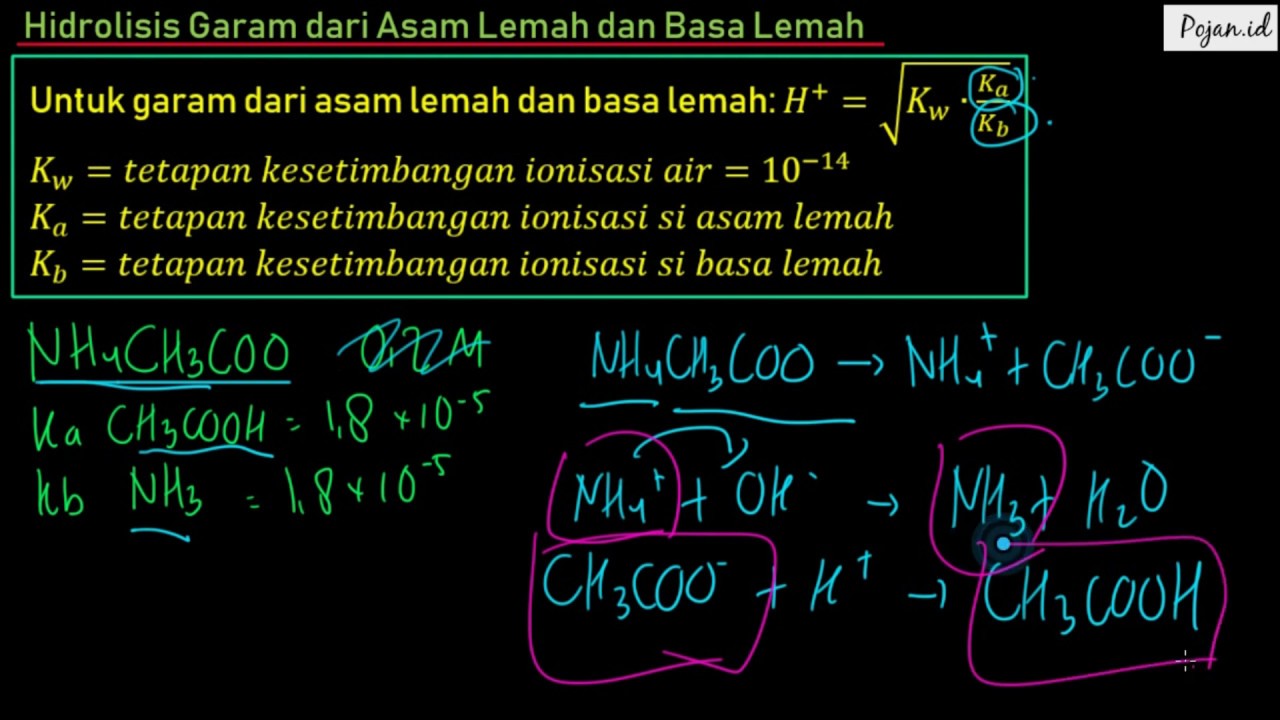
[H +] = derajat hidrolisis. Rumus tak terhidrolisis (asam kuat + basa kuat) \[pH = 7\] Contoh. Terdapat 1,0 L larutan garam NH 4 CH 3 COO 0,25 M. Diketahui K a CH 3 COOH = 1,75 x 10-5 mol/L dan K b NH 3 = 1,8 x 10-5 mol/L berapakah nilai tetapan hidrolisis adalah . . .

Mari bertanya! Tanya MIPI
Latihan Soal ph Larutan Hidrolisis (Sedang) Pertanyaan ke 1 dari 5. 1. Pertanyaan. Suatu larutan dengan pH p H 5 - log log 2, terbentuk dari reaksi 75 mL larutan NH4OH NH 4 OH 0,4 M dengan larutan H2SO4 H 2 SO 4 0,2 M. Tentukan tetapan hidrolisis dari garam yang terbentuk! 1. 1 ×10−9 1 × 10 − 9. 2. 2 ×10−9 2 × 10 − 9.

Derajat hidrolisis dari larutan NH4Cl 0,001 M adalah(...
Oleh karena itu garam dapat terbentuk dari 4 reaksi hidrolisis kimia sebagai berikut: Garam yang berasal dari asam lemah dan basa kuat bersifat netral dan memiliki pH = 7, yang artinya tidak terjadi hidrolisis. Garam dari asam kuat dan basa lemah, di mana garam ini akan memiliki pH < 7 alias bersifat asam. Garam dari asam lemah dan basa kuat.

Hidrolisis Garam Natrium Asetat Derajat Hidrolisis Bagian Teori YouTube
Hidrolisis garam merupakan salah satu komponen dan pembelajaran penting yang bisa kamu pelajari di bab larutan. Materi ini menjelaskan mengenai reaksi yang terjadi ketika garam diuraikan oleh air. Selain itu, kamu juga akan mmepelajari bagaimana sifat dari larutan garam yang digunakan dalam kimia. Saking pentingnya, Wardaya College menjadikan.

Soal Hidrolisis Garam Dan Penyelesaiannya
Derajat hidrolisis (h) adalah perbandingan jumlah zat yang terhidrolisis (bereaksi dengan air) dengan jumlah zat sebelum terhidrolisis . Derajat hidrolisis dapat diperoleh dari akar hasil bagi antara K h dengan konsentrasi garam. Baca pembahasan lengkapnya dengan daftar atau masuk akun Ruangguru. GRATIS!

Rumus Penyangga Dan Hidrolisis PDF
Rumus: Keterangan: Kw = konstanta air Kb = konstanta basa Kh = konstanta hidrolisis (G) = konsentrasi garam h = derajat hidrolisis. Untuk menentukan besar kecilnya derajat hidrolisis garam yang berasal dari asam kuat dan basa lemah dapat menggunakan rumus berikut. 3. Garam yang Berasal dari Asam Lemah dan Basa Kuat

Contoh Soal Hidrolisis Dan Pembahasannya
h: Derajat hidrolisis. Sedangkan untuk menentukan besar derajat hidrolisis garam dari asam kuat dan basa lemah, maka dipakai rumus seperti gambar di bawah ini: 2. Rumus Hidrolisis dari Komponen Asam Lemah dan Basa Kuat. Garam dari asam lemah dan basa kuat di dalam air nantinya akan mengalami hidrolisis sebagian.

Hidrolisis Garam Soal Jawab 1 Reaksi hidrolisis, konstanta hidrolisis, derajat hidrolisi dan pH
Pengertian Hidrolisis, Macam, Manfaat, Rumus, dan Contohnya. Oleh Ilmu Kimia Diposting pada 5 Maret 2022. Hidrolisis Adalah. Hidrolisis pada hakekatnya adalah salah satu arti reaksi kimia sederhana yang paling sering terjadi dalam kehidupan kita. Reaksi hidrolisis ini merupakan reaksi yang melibatkan molekul air dalam pemecahan senyawa.

Derajat hidrolisis dari larutan CH3COONa 0,1 M adalah…( Ka CH3COOH = 105). YouTube
Hidrolisis adalah suatu reaksi kimia di mana sebuah molekul dipisahkan menjadi dua bagian melalui penambahan molekul air (H2O). Rumus hidrolisis, beserta pengertian, sifat, cara menghitung, dan Ngakak

Hidrolisis Garam Pengertian, Macam, Dan Rumus, Beserta Contoh Soalnya Secara Lengkap
Secara matematis dapat dituliskan: %hidrolisis = jumlah zat setelah hidrolisis jumlah zat sebelum hidrolisis × 100%. Derajat hidrolisis (h) = Kh [G]−−−√. Pada hidrolisis anion Kh = Kw Ka. Pada hidrolisis kation Kh = Kw Kb. Soal-1: Hitung pH saat titik ekivalen tercapai pada proses titrasi 25 mL HC 2 H 3 O 2 0,1000 M dengan 0,1000 M NaOH.

Jika Ka HCN=7 x 10^(10) dan Kw=10^(14) , derajat hid...
Hidrolisis garam amonium klorida akan mengasilkan larutan asam dengan pH di bawah 7. Dari persamaan tersebut, kita dapat menghitung derajat hidrolisisnya untuk menghitung pH larutannya. Rumus hidrolisis yang digunakan sebagai berikut: Keterangan: Reaksi Hidrolisis Garam dari Asam Lemah dan Basa Kuat. Photo by Uby Yanes on Unsplash
Hidrolisis Garam dari Asam Lemah dan Basa Lemah Materi Hidrolisis Garam Kimia SMA Pojan.id
Hidrolisis Garam - Pengantar. Ketika suatu asam bereaksi dengan suatu basa maka akan dihasilkan senyawa ionik yang disebut garam. Larutan garam dapat bersifat netral, asam, ataupun basa. Hal ini dikarenakan terjadinya hidrolisis garam, yaitu reaksi dari suatu kation atau suatu anion, ataupun keduanya, dengan air menghasilkan ion H + (aq) atau.