
Adiabatic Suhu Pengertian, Proses serta Persamaannya geografi81
Rumus ini dapat digunakan untuk menghitung perubahan suhu gas ideal pada proses adiabatik. Rumus adiabatik dapat dituliskan sebagai: T2/T1 = (P2/P1)^ (γ-1)/γ. di mana T1 dan T2 merupakan suhu awal dan akhir gas ideal, P1 dan P2 merupakan tekanan awal dan akhir gas ideal, serta γ merupakan konstanta termodinamika yang bergantung pada jenis.
%2C+yaitu+Q+%3D+0..jpg)
Rumus Adiabatik Meteor
Hubungan tekanan dan volume dalam proses adiabatis sangat unik ,karena terhubung dengan konstanta Laplace. Ini dapat dibuktikan dengan mudah .Untuk lebih dap.

Soal dan Pembahasan Usaha Termodinamika Pada Proses Adiabatik YouTube
Adiabatic Process. An adiabatic process is one in which no heat is gained or lost by the system. The first law of thermodynamics with Q=0 shows that all the change in internal energy is in the form of work done. This puts a constraint on the heat engine process leading to the adiabatic condition shown below. This condition can be used to derive.
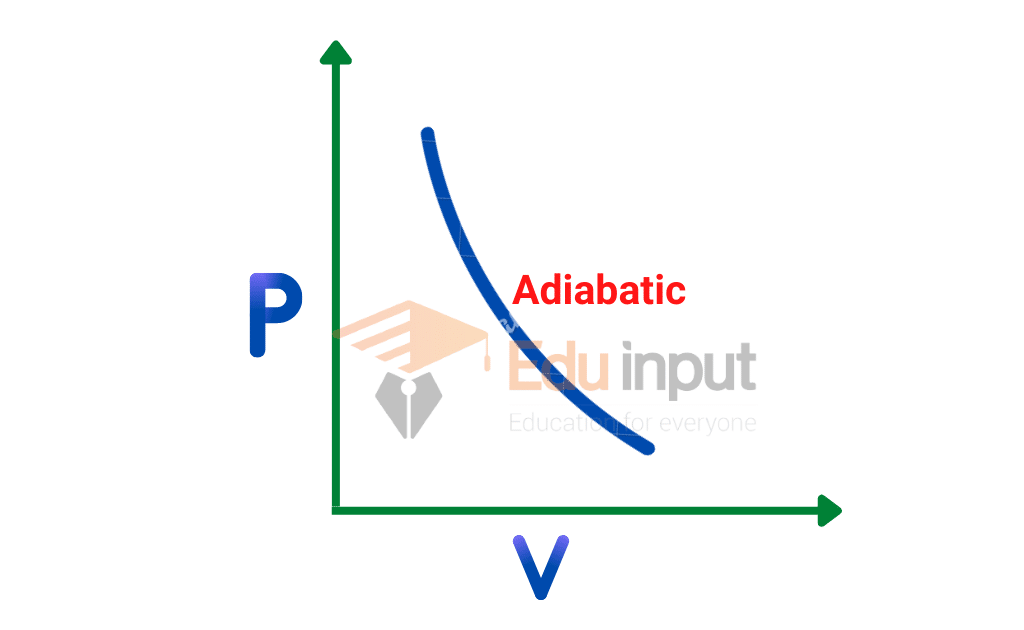
What is Adiabatic ProcessDefinition, Types, And Example
Sedangkan, jika volume diturunkan (dikompresi), maka suhu sistem akan naik. Adapun, sistem termodinamika dapat memiliki lebih dari satu jenis proses termodinamika. Misalnya, suatu sistem dapat mempertahankan suhu dan jumlah kalor di dalamnya dengan menjalankan proses isotermal dan adiabatik.

Proses ADIABATIK Bahas Tuntas Materi & Soal Lengkap Termodinamika adiabatik termodinamika
An adiabatic process (Greek: adiábatos, "impassable") is a type of thermodynamic process that occurs without transferring heat or mass between the thermodynamic system and its environment.Unlike an isothermal process, an adiabatic process transfers energy to the surroundings only as work. As a key concept in thermodynamics, the adiabatic process supports the theory that explains the first law.

Gambar Grafik Proses Adiabatik
Pembatas adiabatik: tidak memperbolehkan pertukaran panas. Pembatas rigid:. Rumus Hukum Termodinamika 1. Secara matematis hukum I termodinamika dapat dirumuskan sebagai berikut: Q = ∆U+W. Dengan ketentuan, jika: Q(+) → sistem menerima kalor OR → sistem melepas kalor

Gambar Grafik Proses Adiabatik
Rumus Lengkap Fisika Temodinamika. rumus hitung · Nov 17, 2013 · 1 Comment. Dalam termodinamika ada dua istilah yang familiar yaitu sistem dan lingkungan. Sistem adalah sejumlah gas dalam benda dengan volume tertutup. Lingkungan adalah benda-benda yang berada diluar sisitem.

TERMODINAMIKA DASAR LENGKAP ISOKHORIK, ISOBARIK, ISOTERMIK, ADIABATIK YouTube
Subbagian ini akan menjelaskan rumus-rumus Hukum Pertama dan Hukum Kedua Termodinamika. Hukum Pertama Termodinamika.. Proses adiabatik adalah perubahan keadaan gas dimana tidak ada kalor yang masuk maupun keluar dari sistem. Persamaan keadaan adiabatik:.

Hukum I Termodinamika dan Contoh Soal
PENURUNAN RUMUS PROSES ADIABATIK ATAU ADIABATIS. Proses adibatis adalah proses perubahan keadaan pada gas yang tanpa perubahan kalor ΔQ = 0 pada proses ini proses penurunan persamaan usaha gas jarang dituliskan di buku-buku SMA. Bagi yang ingin mempelajari lebih dalam tentang proses penurunan persamaan usaha pada proses adiabatis di bawah ini.

Soal dan Pembahasan Usaha Termodinamika pada Proses Isotermal dan Adiabatik YouTube
Rumus-rumus ini masih sangatlah sederhana daripada pengembangan rumus-rumus yang lainnya dalam proses Adiabatik ini. 3. Penurunan rumus diskrit. Penurunan rumus ini lebih kompleks dari penurunan rumus pemanasan dan pendingan yang sebelumnya. Butuh ilmu yang dalam untuk menjelaskan akan penurunan rumus kali ini.

A look at the adiabatic equation YouTube
Nah, jika proses isobarik ini jika didasarkan pada Hukum Termodinamika I, maka akan berlaku rumus: Sementara grafik usaha gas dalam proses isobarik dapat dinyatakan sebagai: 4. Proses Adiabatik (Kalor Tetap) Proses adiabatik adalah proses termodinamika yang cara kerjanya dilakukan oleh gas murni yang berasal dari perubahan energi internalnya.
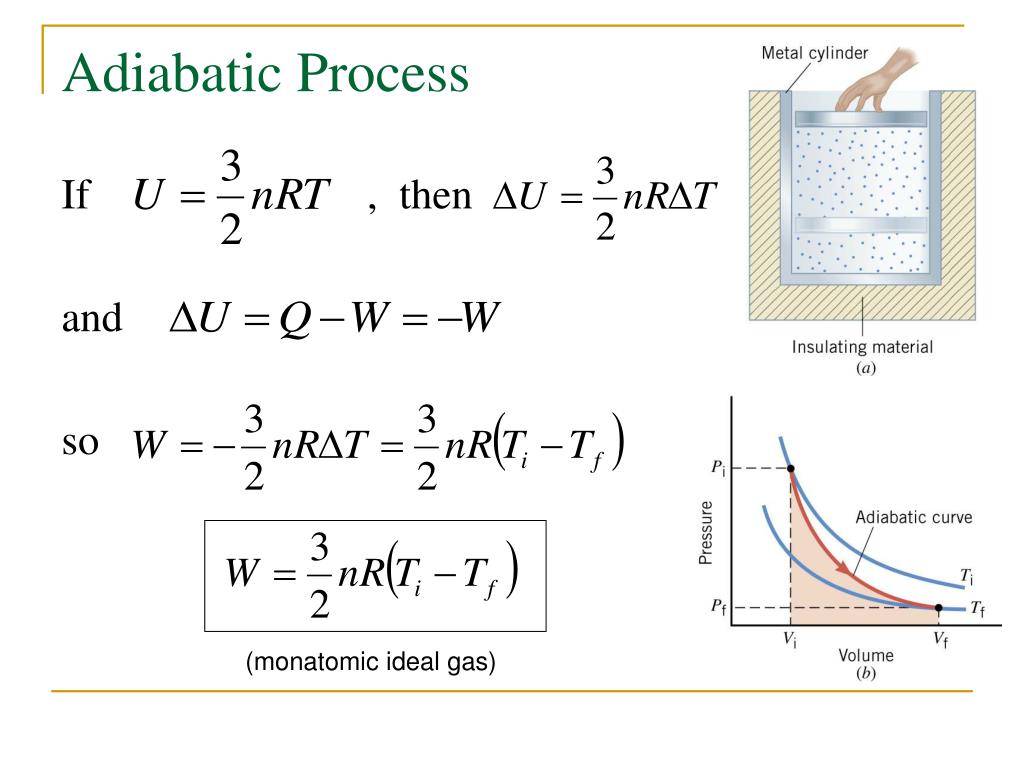
PPT Thermodynamics PowerPoint Presentation, free download ID3150253
Rumus diatas didapatkan dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal. 4. Adiabatik. Adiabatik merupakan proses termodinamika yang gak mengubah nilai kalor sistem (Q = 0). Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik ini bisa dinyatakan dengan persamaan berikut ini: W = (-3/2).n.R.ΔT

Nilai Rumus N Pada Adiabatik
Dalam proses adiabatik tidak ada panas yang masuk dan keluar sehingga Q = 0. Rumus : Artinya pada proses adiabatik seluruh kerja yang dilakukan/diterima gas digunakan untuk menurunkan/menaikkan energi dalam gas. Contoh untuk volume gas bertambah atau gas melakukan usaha dimanfaatkan dalam kulkas atau penyejuk udara (AC) untuk menurunkan suhu.
Proses Adiabatik, pengertian, contoh, contoh soal, dinamika adiabatik
Adiabatik rumus adalah salah satu konsep dasar dalam fisika, khususnya termodinamika. Jadi, jika kamu tertarik dengan dunia fisika, maka artikel ini wajib untuk kamu baca sampai selesai.Adiabatik rumus dapat digunakan untuk menghitung perubahan suhu atau tekanan gas pada sistem tertutup. Konsep adiabatik sendiri merujuk pada proses terisolasi.

Persamaan Boyle Gay lussac dan penjelasan isobarik isotermal isokhorik adiabatik dan contoh soal
Rumus Perhitungan Perubahan Energi Dalam Sistem Gas Ideal Proses Adiabatik. Perubahan energi dalamnya dapat dihitung dengan mengunakan rumus atau persamaan berikut: ΔU = (3/2) n R DT. ΔU = (3/2) x ( 2) x (8,314) x (62 O C - 37 O C) ΔU = 623,7 Joule. Jadi Perubahan energi dalam sistem adalah 623,7 J.
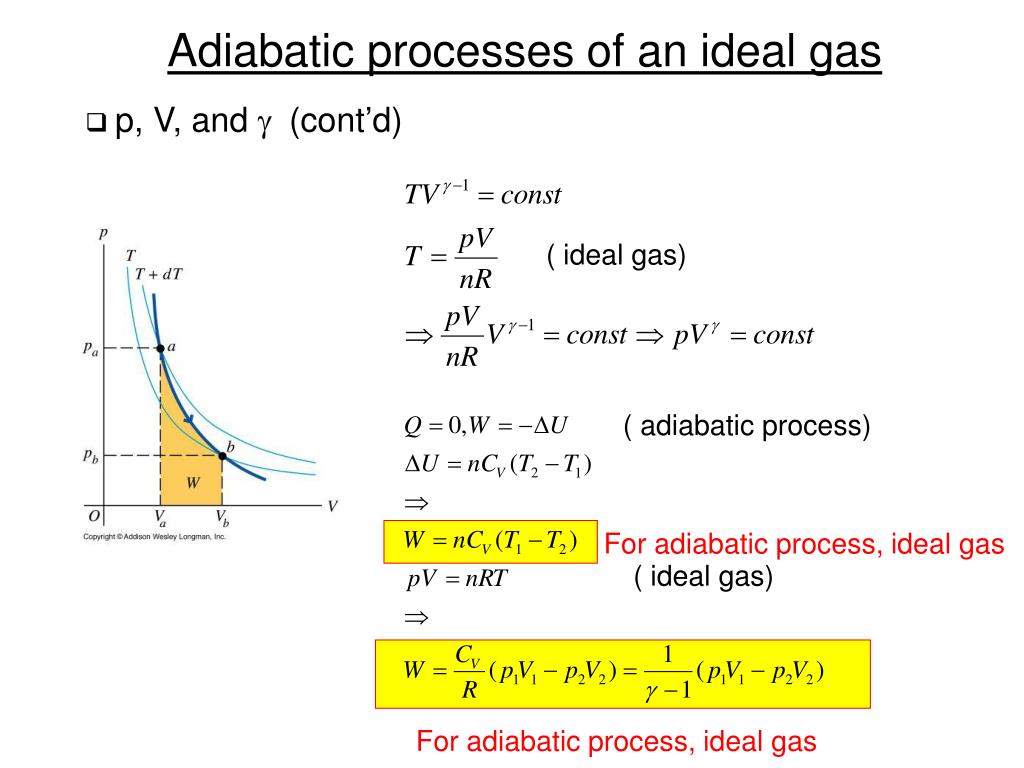
PPT Chapter 18 Heat,Work,the First Law of Thermodynamics PowerPoint Presentation ID596919
Cara menjawab soal ini sebagai berikut: ΔU = Q - W. ΔU = 3500 - 3000 = 500 joule. Jadi perubahan energi dalam sistem sebesar 500 joule. Contoh soal 10. Suatu gas berada dalam ruang tertutup bervolume 5 m 3 dan tekanan 4 . 10 5 Pa. Hitunglah usaha yang dilakukan gas jika gas mengalami proses isobarik sehingga volumenya menjadi 4 kali semula.