
PPT KONSEP REAKSI REDUKSIOKSIDASI PowerPoint Presentation, free download ID5404853
Penjelasan Lengkap Reaksi Redoks (Reduksi dan Oksidasi) LENGKAP. Daftar Isi+. Reaksi redoks adalah reaksikimia yang menyebabkan adanya perubahan bilangan oksidasi pada suatu unsur, maupun molekul. Dalam kehidupan sehari-hari seringkali terjadi reaksi redoks. Diantaranya adalah besi yang berkarat, sayuran yang membusuk.

MEKANISME REAKSI OKSIDASI SENYAWA ORGANIK (ALKOHOL)
Dikutip dari buku Sukses UN 2019 SMA/MA Kimia, Tim Pengajar Ganesha Operation (2018:122), salah satu poin perbedaan reduksi dan oksidasi, yaitu pada reaksi reduksi terjadi penurunan bilangan oksidasi. Sedangkan pada reaksi oksidasi terjadi kenaikan bilangan oksidasi.

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
20 questions. 1. Multiple Choice. Pada reaksi redoks, spesies yang mengalami peristiwa oksidasi adalah…. 2. Multiple Choice. Pernyataan yang tidak benar tentang reaksi reduksi berikut adalah…. 3. Multiple Choice.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Jadi, reaksi oksidasi terdapat pada nomor 1 ditandai dengan adanya pengikatan oksigen dan 4 ditandai dengan adanya kenaikan biloks dari +5 menjadi +7. Baca Juga : Soal Hidrolisis Garam. 41. Perhatikan persamaan reaksi redoks yang terjadi pada proses pembuatan gas klorin dalam industry berikut:

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Unsur-unsur bahkan dalam bentuk molekul ini kerap kali mempunyai bilangan oksidasi nol. Pada reaksi diatas hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sementara itu fluorin tereduksi dari bilangan oksidasi 0 menjadi -1. Saat reaksi oksidasi dan reduksi digabungkan elektron yang terlibat akan saling mengurangi:

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Bahkan pada reaksi oksidasi terjadi kenaikan bilangan oksidasi. Maka sebaliknya, reduksi dikenal dengan pelepasan oksigen, pengikatan elektron dan terjadi penurunan bilangan oksidasi. Nah itulah pengertian dari reaksi reduksi oksidasi yang terjadi selalu bersama-sama, sehingga disebut dengan reaksi redoks.

Reaksi oksidasi soal kimia SMA YouTube
Reaksi redoks adalah reaksi yang terjadi di mana reaksi oksidasi dan reduksi terjadi bersama-sama. 2 Na(s) + S(s) Na 2S(s) Reaksi di atas dapat ditulis menjadi 2 tahap yaitu: Reaksi oksidasi : 2 Na(s) 2 Na + (aq) + 2 e - Reaksi reduksi : S(s) + 2 e - 2- (aq) Reaksi redoks : 2 Na (s)+ S Na 2S(s) Pada reaksi di atas Na mengalami reaksi oksidasi
Cara Menyetarakan Reaksi Redoks dengan Metode Bilangan Oksidasi Materi Kimia
Contoh Soal Redoks. Reaksi redoks bisa Sobat Pijar temui ketika terjadi pembakaran bensin dalam mesin mobil. Pada saat pembakaran, karbon dalam bensin bereaksi dengan oksigen di udara, melepaskan energi dan menghasilkan produk pembakaran, seperti karbon dioksida dan air. Reaksi Redoks juga bisa kamu lihat pada proses fotosintesis tanaman.

Reaksi berikut yang merupakan reaksi oksidasi adalah....
Oksidasi dan reduksi adalah dua istilah yang sangat umum ditemukan pada penerapan ilmu kimia.Keduanya berhubungan dengan peran pada suatu arti reaksi kimia yang melibatkan atom, unsur, hingga senyawa yang terkandung dalam bahan kimia.. Selain itu dalam suatu reaksi oksidasi dan reduksi tidak dapat dipisahkan oleh serah terima elektron, penerimaan dan pelepasan oksigen serta hidrogen, terakhir.

Cara menentukan Biloks ( Bilangan Oksidasi ) Reaksi Redoks YouTube
Reaksi Pergantian. Redoks terjadi pada reaksi pergantian tunggal atau bisa disebut reaksi substitusi. Komponen redoks dalam reaksi ini adalah pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, bukan pada pergantian atom senyawanya. Sebagai contoh pada larutan besi dan tembaga(II) sulfat. Fe + CuSO4 → FeSO4 + Cu Persamaan ion.

PPT REAKSI REDUKSI OKSIDASI PowerPoint Presentation, free download ID5653756
Menentukan Reaksi Reduksi dan Oksidasi Berdasarkan Konsep Kenaikan dan Penurunan Bilangan Oksidasi. Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator.

Reaksi oksidasi senyawa senyawa organik
Sementara itu, terjadi reaksi oksidasi pada senyawa yang lagi dibakar tersebut. Fotosintesis. Selama proses fotosintesis, karbon dioksida mengalami reaksi reduksi, sementara air mengalami reaksi oksidasi. Apel yang dibiarkan di ruangan terbuka. Reaksi oksidasi terlihat pada apel yang berubah warna jadi coklat setelah terkena oksigen. Dekomposisi.
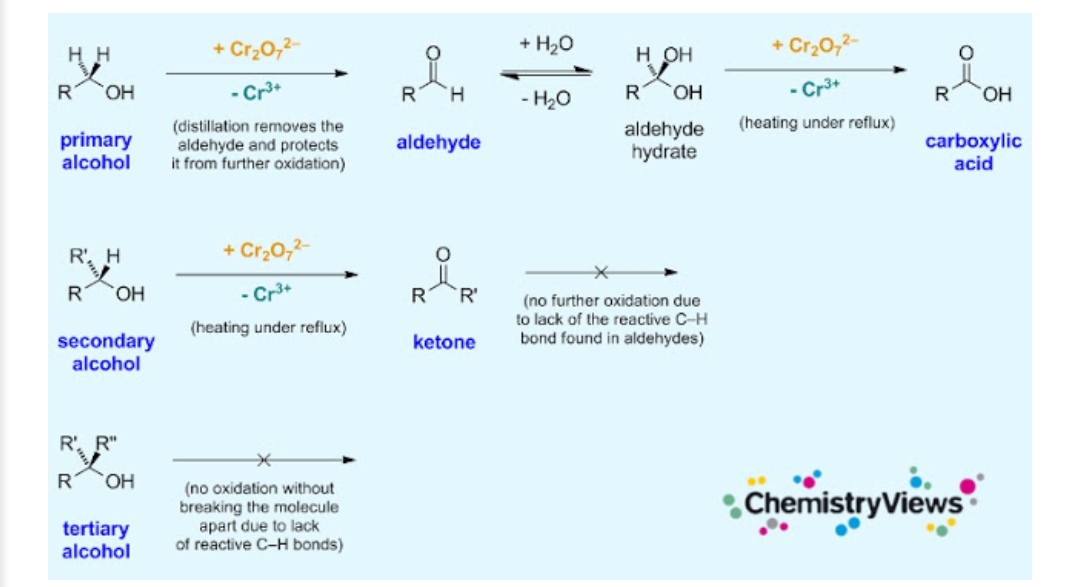
MEKANISME REAKSI OKSIDASI PADA BERABAGAI SENYAWA ORGANIK
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Kelompok Persamaan Reaksi Yang Mengalami Reduksi Ditunjukkan Oleh Nomor Terbaru
15 questions. 15 questions. 1. Multiple Choice. 1 minute. 1 pt. Pada reaksi redoks, spesies yang mengalami peristiwa oksidasi adalah…. Spesies yang melepas oksigen. Spesies yang menangkap elektron.

Mekanisme Reaksi Oksidasi Alkohol dengan Reaksi Oksidasi Swern YouTube
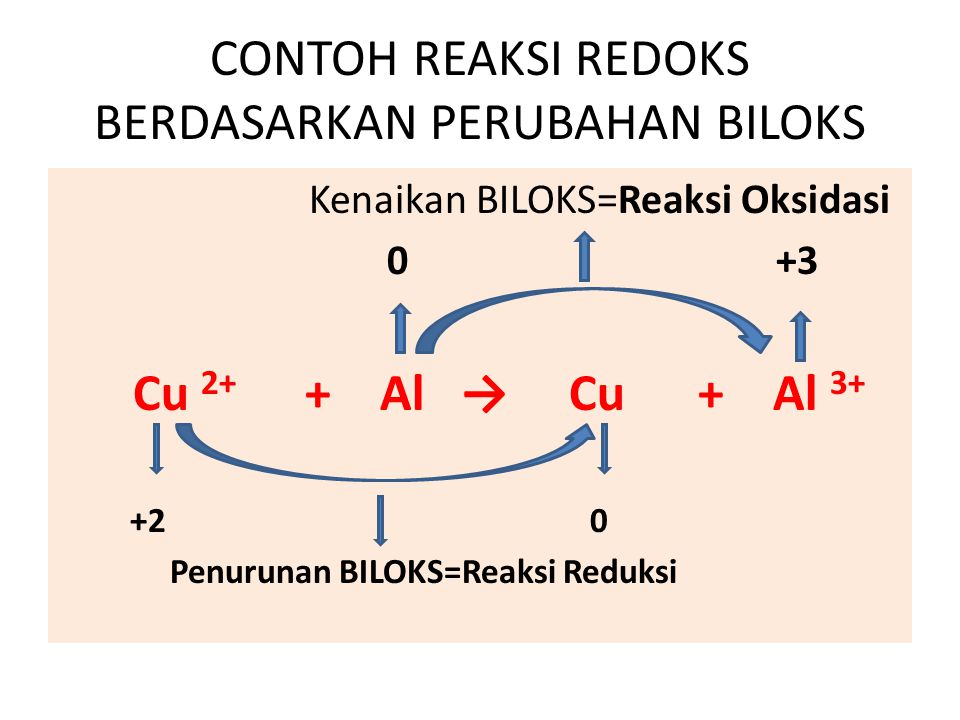
S + 2e → S 2-. 2. Cu 2+ + 2e → Cu. 3. Berdasarkan Perubahan Bilangan Oksidasi. Berdasarkan perubahan bilangan oksidasinya, pengertian reaksi oksidasi adalah reaksi peningkatan bilangan oksidasi sedangkan reaksi reduksi adalah reaksi penurunan bilangan oksidasi. Contoh Reaksi : 4FeO + O 2 → 2Fe 2 O 3.

Reaksi Reduksi Oksidasi dalam Kimia Organik (Kimia SBMPTN, UN, SMA) YouTube
Contoh dalam proses berkaratnya besi terjadi reaksi: 2 Fe → 2 Fe3+ + 6 e (oksidasi) artinya 6 elektron dilepas oleh 2 atom ferum; 3 O2 + 6 e → 3 O2- (reduksi) artinya 3 atom oksigen membentuk senyawa Fe2O3; 3. Konsep Reaksi Redoks Berdasarkan Bilangan Oksidasi