
Tuliskan Reaksi Hidrolisis Dan Sifat Dari Garam Berikut A Naf B Fe My XXX Hot Girl
Step 4: Substitute Coefficients and Verify Result. Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. 6 KCl + 8 HNO3 = 6 KNO3 + 3 Cl2 + 2 NO + 4 H2O. Reactants.
PPT Hidrolisis didefinisikan sebagai reaksi dengan air PowerPoint Presentation ID3918911
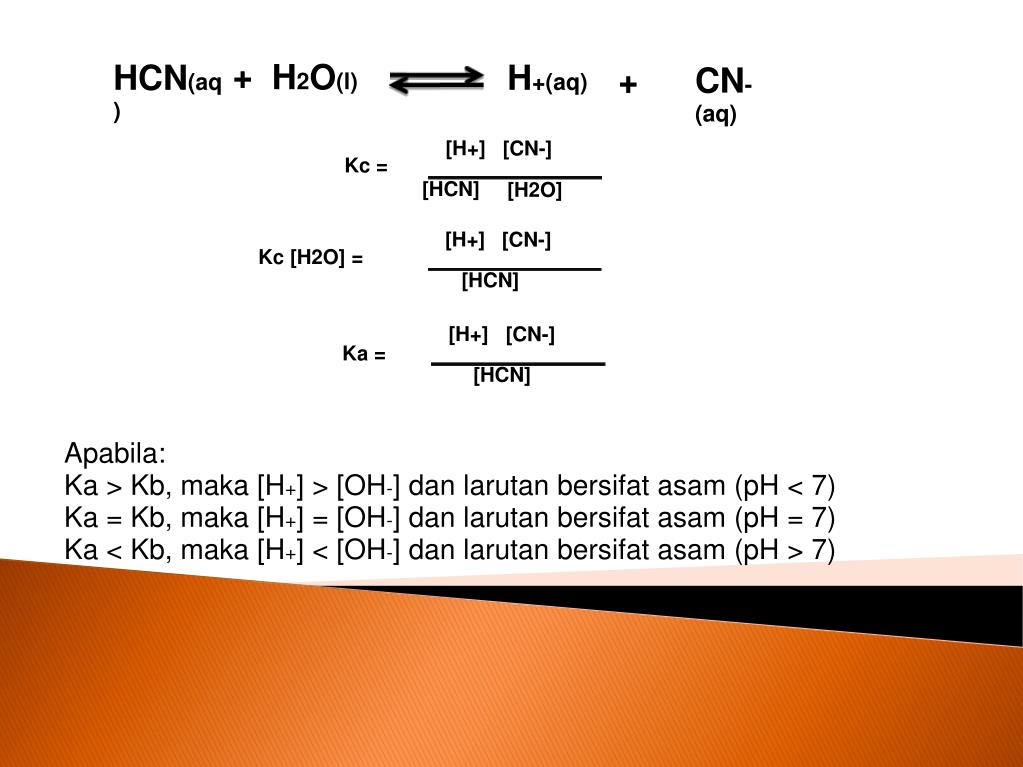
Hidrolisis berasal dari bahasa Yunani "hydro" yang berarti air dan "lysis" yang berarti lepas atau penguraian. Hidrolisis garam dapat diartikan sebagai reaksi reversible penguraian garam oleh air. Sehingga, hidrolisis garam adalah reaksi antara salah satu ion-ion garam (kation atau anion) dengan air dan membentuk larutan bersifat asam.
PPT Hidrolisis didefinisikan sebagai reaksi dengan air PowerPoint Presentation ID3918911
Definisi : Hidrolisis adalah jenis reaksi dekomposisi dimana salah satu reaktannya adalah air ; dan biasanya, air digunakan untuk memutuskan ikatan kimia dalam reaktan lain. Hidrolisis dapat dianggap kebalikan dari reaksi kondensasi, di mana dua molekul bergabung satu sama lain, menghasilkan air sebagai salah satu produk.

Pasangan persamaan reaksi hidrolisis yang bersifat basa adalah Universityku
Pengertian Hidrolisis, Macam, Manfaat, Rumus, dan Contohnya. Oleh Ilmu Kimia Diposting pada 5 Maret 2022. Hidrolisis Adalah. Hidrolisis pada hakekatnya adalah salah satu arti reaksi kimia sederhana yang paling sering terjadi dalam kehidupan kita. Reaksi hidrolisis ini merupakan reaksi yang melibatkan molekul air dalam pemecahan senyawa.

Terbaru 38 Reaksi Elektrolisis Riset
Pengertian Hidrolisis. Hidrolisis berasal dari bahasa Yunani Kuno yaitu Hidro yang berarti "Air" dan Lisis yang berarti "tidak mengikat". Setiap reaksi kimia pada hidrolisis dimana molekul air memecah satu atau lebih ikatan kimia. Istilah hidrolisis secara luas digunakan untuk reaksi substitusi, eliminasi dan solvaso dimana air adalah.

Konsep Reaksi Hidrolisis Garam Materi Hidrolisis Garam Kimia SMA Kelas 11 YouTube
Contoh Soal Hidrolisis. Manfaat Hidrolisis Garam dalam Kehidupan. Dalam kehidupan kita, banyak reaksi kimia yang sering terjadi. Baik itu reaksi sederhana maupun reaksi kimia yang kompleks. Salah satu reaksi sederhana yang sering terjadi adalah hidrolisis. Hidrolisis merupakan suatu reaksi yang melibatkan molekul air untuk pemecahan senyawa.

Dari reaksi(1) Br2+KCl (2) F2+KBr (3) Cl2+MgBr2(4) I2+N...
Pembahasan : Hidrolisis yang berasal dari asam lemah dan basa lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air. Dari soal diatas penyusun dari garam NH 4 CN adalah NH 4 OH ( basa lemah ) dan HCN ( asam lemah ) Dan akan terjadi hidrolisis total. Maka NH 4 CN akan terionisasi menjadi NH 4+ dan CN - .

Mno2 Kclo3 Koh Kmno4 Kcl H2o EDUCA
We would like to show you a description here but the site won't allow us.
hasil reaksi hidrolisis dari adalah......
Pengertian Hidrolisis Garam Hidrolisis garam adalah reaksi penguraian yang terjadi antara kation dan anion garam dengan air dalam suatu larutan. Kation dan anion yang dapat mengalami reaksi hidrolisis adalah kation dan anion garam yang termasuk elektrolit lemah. Sedangkan kation dan anion garam yang tidak terhidrolisis adalah kation dan anion garam yang termasuk elektrolit kuat.

Mno2 Kclo3 Koh Kmno4 Kcl H2o EDUCA
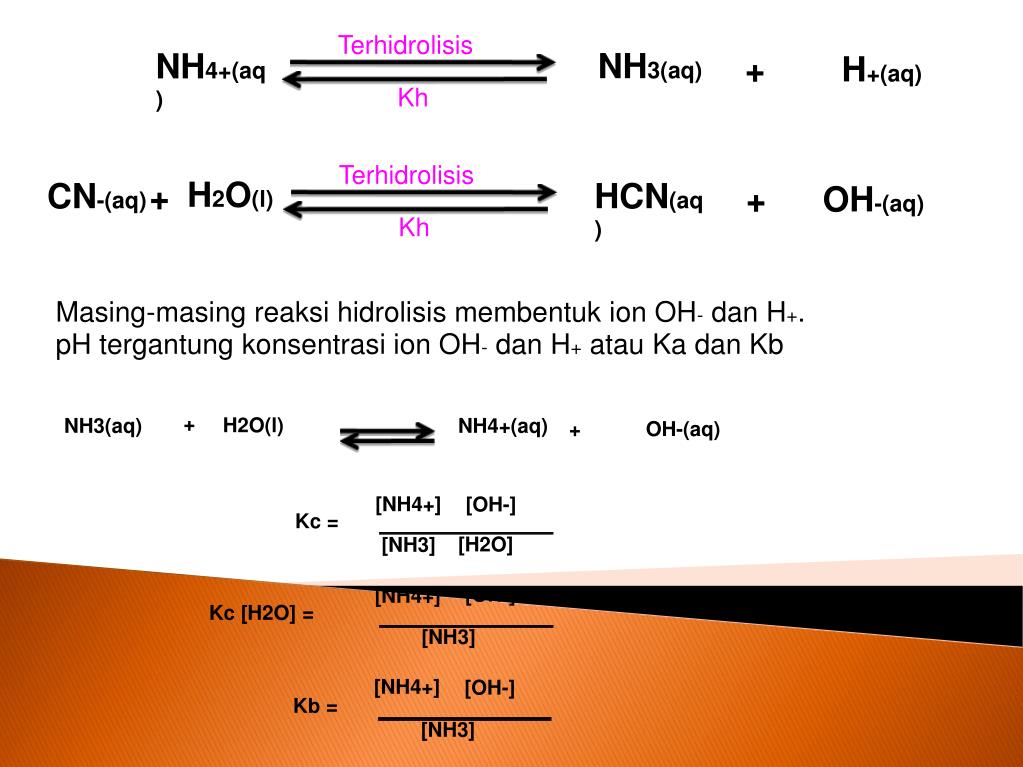
Mekanisme umum untuk reaksi hidrolisis. Kesetimbangan antara hidrolisis dan kondensasi disimbolkan dengan reaksi dua arah.. Hidrolisis adalah penguraian zat dalam reaksi kimia yang disebabkan oleh air. Reaksi kimia dalam hidrolisis memecah molekul air (H 2 O) menjadi kation hidrogen (H +) dan anion hidroksida (OH −). Hidrolisis bergantung pada kimiawi, kelarutan, derajat keasaman dan.

Pasangan persamaan reaksi hidrolisis yang bersifat basa adalah Universityku
Namun, tahukah kamu bahwa tidak semua garam dapat mengalami hidrolisis. Ada beberapa garam yang tidak terhidrolisis. Perlu diketahui bahwa istilah garam dalam ilmu kimia tidak hanya berarti garam dapur. Dilansir dari Lumen Learning, garam adalah senyawa ionik apa pun (larut atau tidak larut) yang terbentuk dari reaksi antara asam dan basa.

Suatu reaksi hidrolisis garam formiat digambarkan sebagai...
KCl (aq) → K+ (aq) + Cl- (aq) K+ (aq) + H2O (l) → Tidak terjadi reaksi Cl- (aq) + H2O (l) → Tidak terjadi reaksi 2. Garam dari Asam Kuat dengan Basa Lemah Garam yang terbentuk dari asam kuat dengan basa lemah mengalami hidrolisis sebagian (parsial) dalam air. Garam ini mengandung kation asam yang mengalami hidrolisis.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Lalu, hidrolisis sebagian yaitu ketika hanya sebagian senyawa saja yang terurai atau secara reaksi kimia menggunakan reaksi bolak-balik. Nah, garam berikut yang tidak mengalami hidrolisis adalah NaCl (natrium klorida), KCl (kalium klorida), dan KNO3 (kalium nitrat).

Balance the Redox Reaction for KOH + Cl2 → KClO3 + KCl + H2O YouTube
Contohnya adalah NaCl, KCl, K₂SO₄, dan Ca(NO₃)₂. Garam yang terbentuk dari reaksi antara asam kuat dan basa lemah. Garam ini bersifat asam dengan pH kurang dari 7. Contohnya adalah Zn(ClO₄)₂, NH₄Cl, AlCl₃, dan Fe(NO₃)₂.. Reaksi hidrolisis garam dapat dibedakan menjadi dua kategori utama, yaitu hidrolisis sempurna dan.

Diketahui beberapa reaksi berikut.(1) KCl(s)+AgNO3(aq)
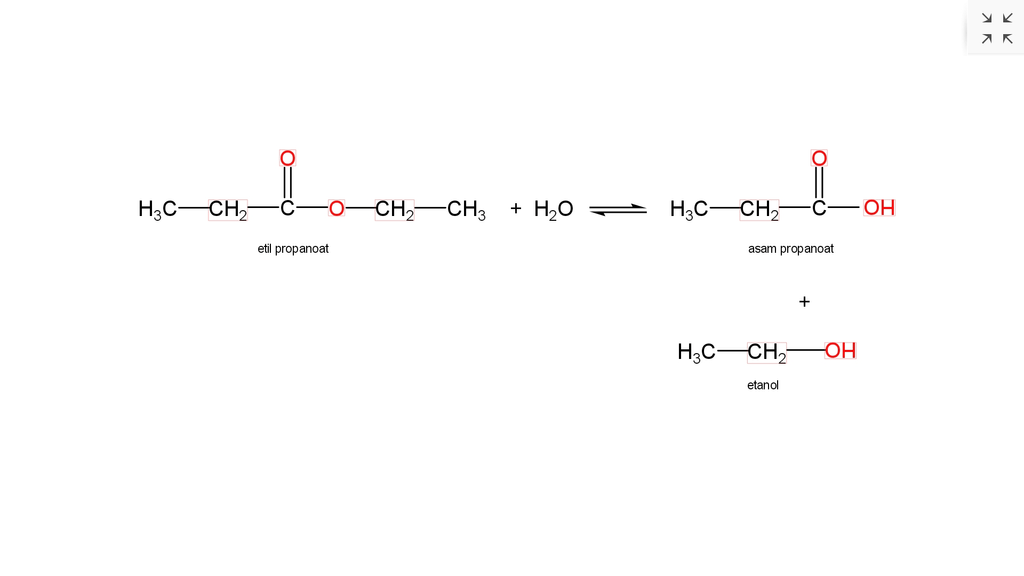
Hidrolisis adalah ciri reaksi kimia yang dekomposisi di mana salah satu reaktan adalah air dan biasanya air tersebutlah yang dipergunakan untuk memutus ikatan kimia dalam reaktan lainnya. Persamaan umum dari reaksi hidrolisis adalah: AB + H 2 O → AH + BOH. Reaksi hidrolisis organik melibatkan reaksi air dan ester: RCO-OR '+ H 2 O → RCO-OH.

Perhatikan Tabel Persamaan Reaksi Hidrolisis Garam Riset
Pembahasan. Langkah pertama kita tuliskan dulu reaksi ionisasi garam tersebut. Ion berasal dari sisa basa kuat, yaitu KOH dan ion berasal dari sisa asam kuat, yaitu HCl. Karena garam KCl berasal dari sisa basa kuat dan sisa asam kuat, maka ion-ion tersebut tidak dapat bereaksi dengan air (tidak terjadi hidrolisis).