Teori Asam dan Basa Menurut BronstedLowry
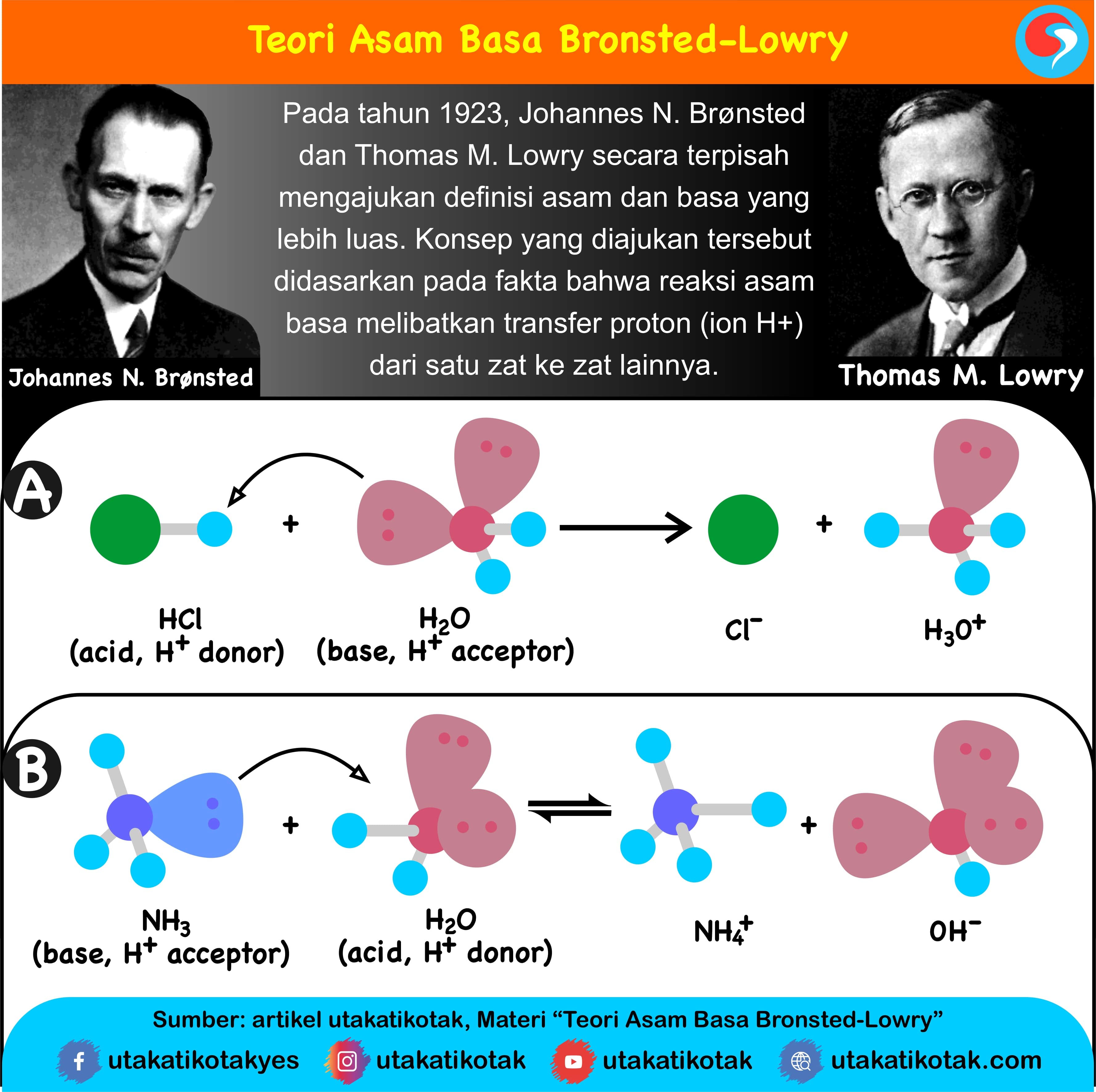
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Teori Asam Basa
Teori Asam Basa Bronsted-Lowry. Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923 mengembangkan teori Arrhenius dengan nama teori asam basa Bronsted-Lowry. Dalam teorinya, Bronsted dan Lowry menjawab kekuranngan yang ada dalam teori Arrhenius yang tidak dapat menyimpulkan senyawa asam basa yang reaksinya tidak membentuk larutan.

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Pada reaksi: H 2 O + CH 3 COO − ⇌ CH 3 COOH + OH − Pasangan asam basa konjugasi menurut Bronsted-Lowry adalah.. SD. SMP. SMA. UTBK/SNBT. Teori asam dan basa menurut teori Bronsted-Lowry adalah sebagai berikut: Asam adalah spesi yang dapat mendonorkan proton dan basa adalah spesi yang dapat menerima proton..

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923.. G.N. Lewis pada tahun 1923 memperkenalkan teori asam-basa dengan basis pada pasangan elektron. Menurut Lewis, asam adalah akseptor pasangan elektron, sedangkan basa adalah donor pasangan.

Cara Mencari Pasangan Asam Basa Menurut Teori Bronsted Lowry AsamBasa YouTube
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H +).

Teori Asam Basa Bronsted Lowry Riset
Dan keduanya disebut dengan pasangan asam basa konjugasi. Agar lebih memahami teori Bronsted-Lowry tentang asam basa konjugasi, marilah kita bahas soal berikut ini! Baca juga: Larutan Asam, Basa dan Garam. Soal: Tentukan pasangan asam basa konjugasi pada persamaan kimia berikut! H2O(l) + NH3(aq) → OH-(aq) + NH4+(aq) Jawaban:

SOLVED pasangan asam basa Brinsted lowry secara berurutan 6 Diketahui persamaan reaksi asam
Sedangkan basa yang telah menerima atau menangkap proton dari asam, disebut sebagai asam konjugasi. Dan keduanya disebut dengan pasangan asam basa konjugasi. Asam: H 2 O Basa: NH 3 Asam konjugasi: NH 4 + Basa konjugasi: OH - Jadi, dapat disimpulkanjawaban asam basa konjugasi yang tepat adalah H 2 O dan OH - kemudian NH 3 dan NH 4 + .

Menentukan Asam Basa Konjugat BronstedLowry YouTube
Video ini berisi tentang bagaimana cara menentukan pasangan asam basa konjugasi dari suatu reaksi asam basa Bronsted-Lowry. Ini adalah materi kimia kelas 11.

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
Asam menurut Lewis adalah zat yang dapat menerima pasangan elektron dari zat lain, sedangkan basa adalah zat yang memiliki pasangan elektron bebas dan mampu mendonorkannya ke zat lain.. Teori asam basa Bronsted Lowry juga tidak hanya berupa molekul saja, tapi juga bisa berupa molekul, senyawa ion, dan ion (kation dan anion)..

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Menurut Brønsted-Lowry, basa adalah spesi yang bertindak sebagai penerima (akseptor) proton. 1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa.

Teori Asam Basa Bronsted Lowry YouTube
Pengertian Asam dan Basa Menurut Bronsted-Lowry. Kekuatan Asam Kuat dan Asam Lemah. Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam basa konjugasi. Perhatikan contoh reaksi berikut: HCl (aq). H 2 O dan H 3 O + merupakan pasangan asam-basa konjugasi.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Istilah asam-basa konjugasi ini muncul dalam Teori Asam-basa Brønsted-Lowry. Istilah asam-basa konjugasi merupakan sentral dalam bahasan kesetimbangan asam-basa di SMA/MA, yang di dalamnya terdiri bahasan larutan penyangga atau larutan bufer serta hidrolisis garam. Penentuan manakah yang termasuk pasangan asam-basa konjugasi dan basa-asam.

Tulislah persamaan reaksi asam basa dibawah ini menurut bronsted lowry dan tentukan pasangan
Menurut Bronsted Lowry asam adalah spesies apa pun yang menyumbangkan proton (H+). Dilansir dari Chemistry LibreTexts, asam yang kehilangan proton berubah menjadi basa konjugasinya. Misalnya, senyawa asam Bronsted HF yang direaksikan dengan air dengan reaksi berikut: HF (aq) + H2O (l) → F- (aq) + H2O+ (aq). Dalam reaksi tersebut, proton dari.