
TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide , menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH.

Get Contoh Soal Asam Basa Menurut Arrhenius Gif
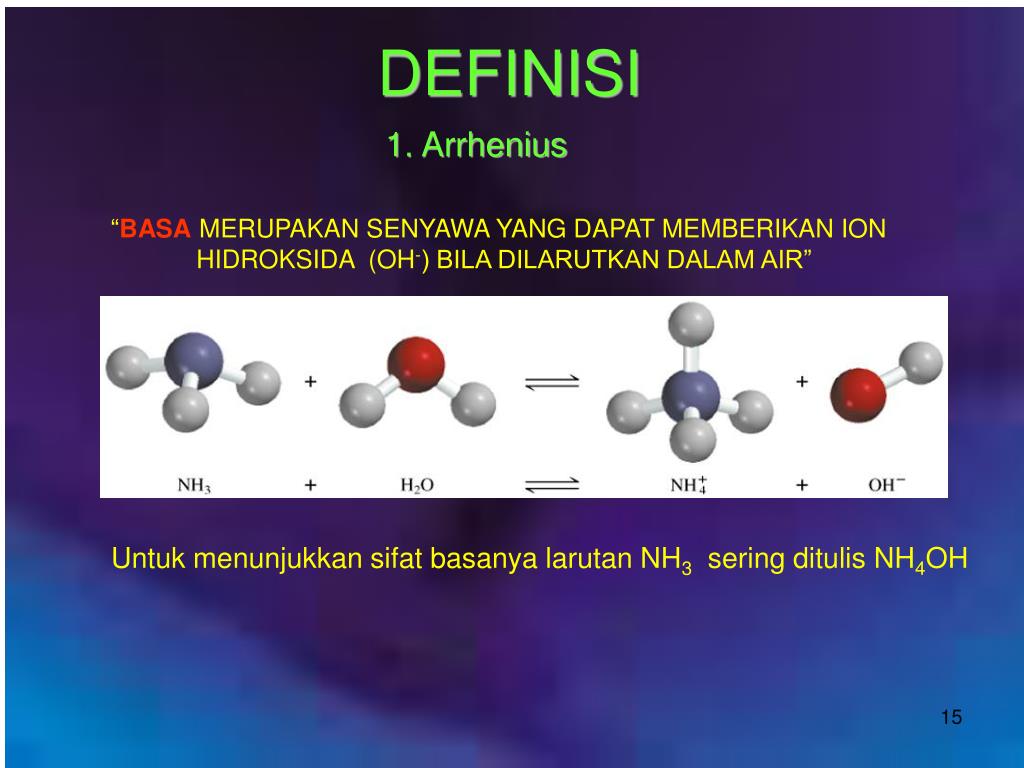
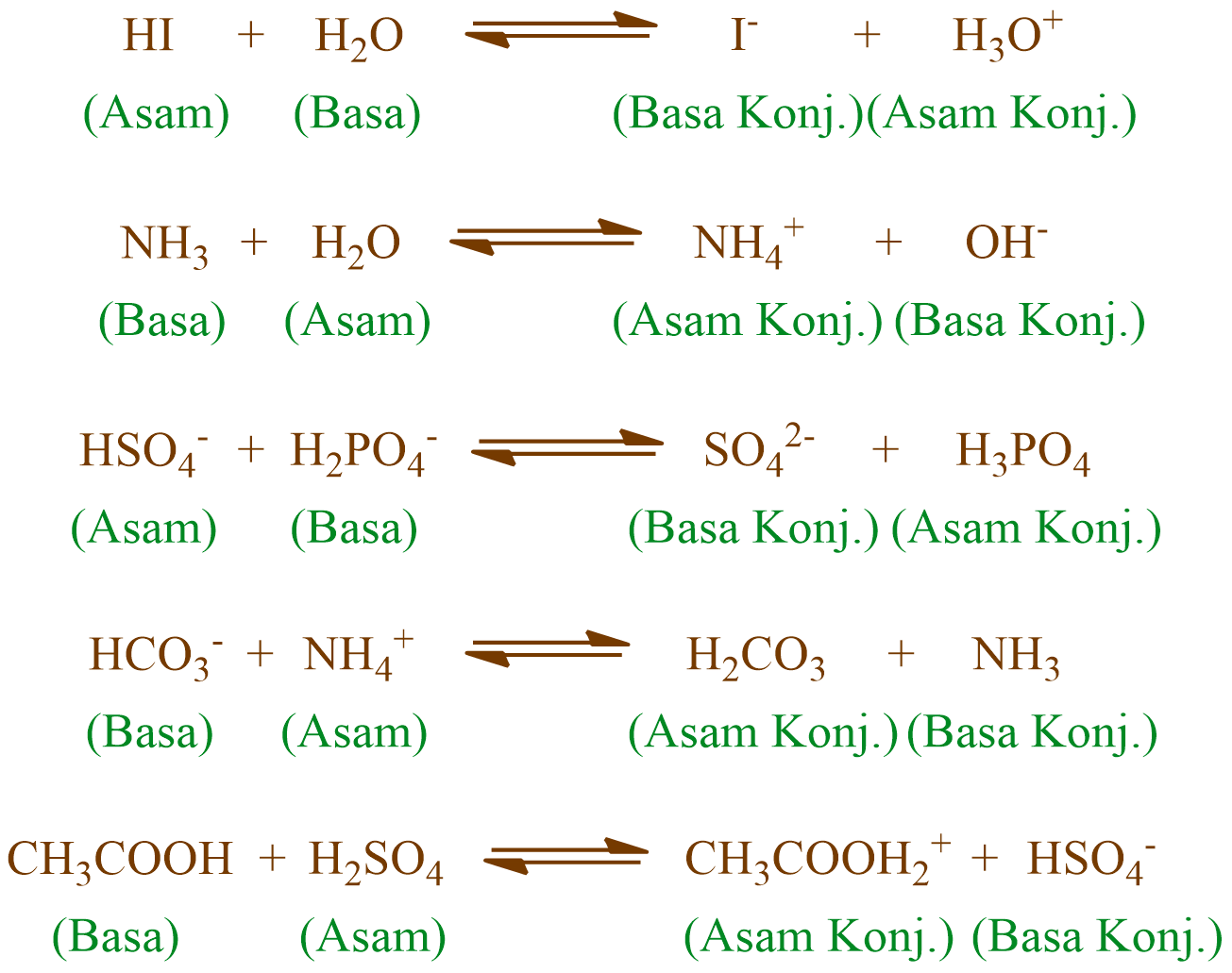
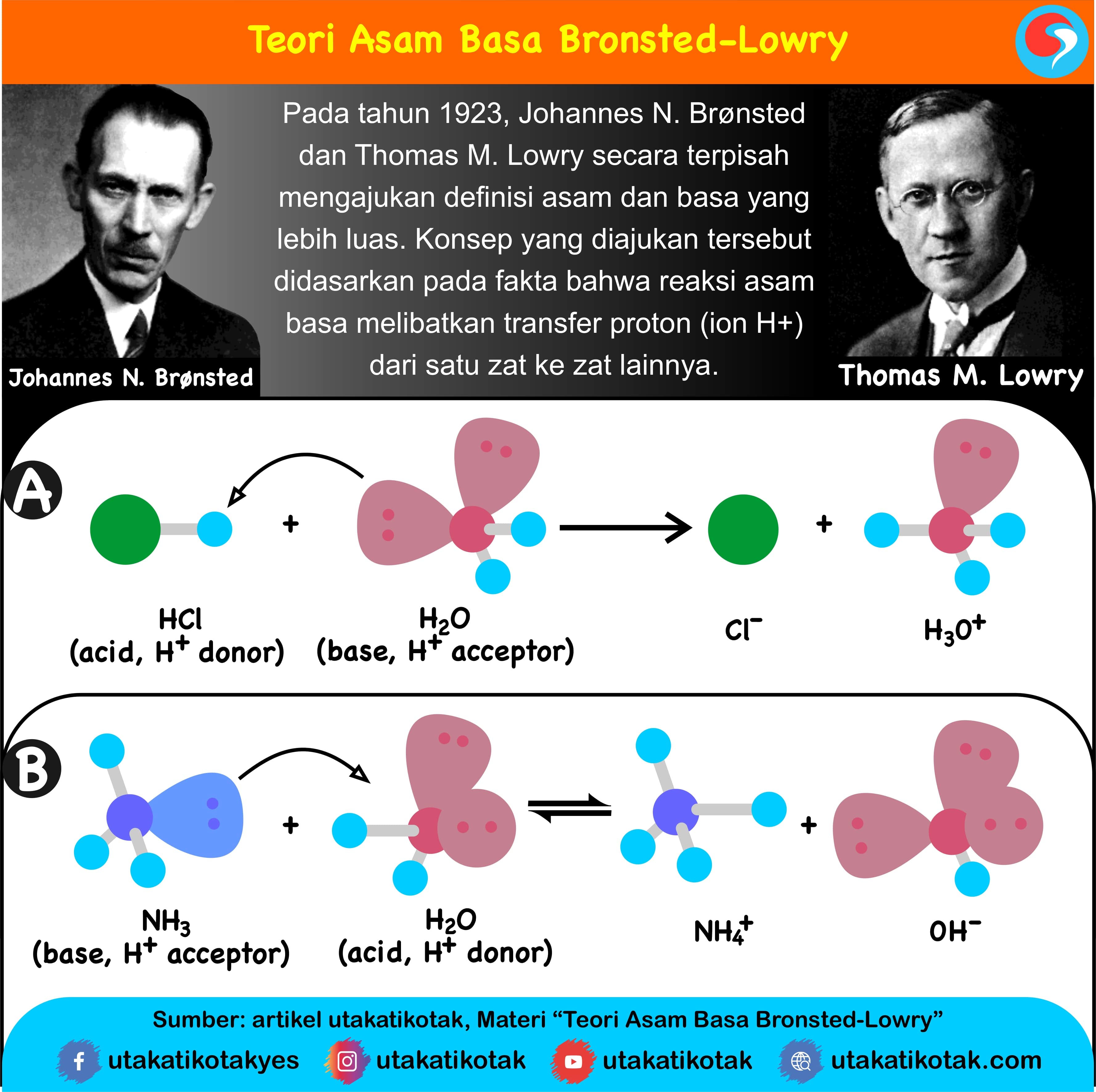
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Teori Asam Basa
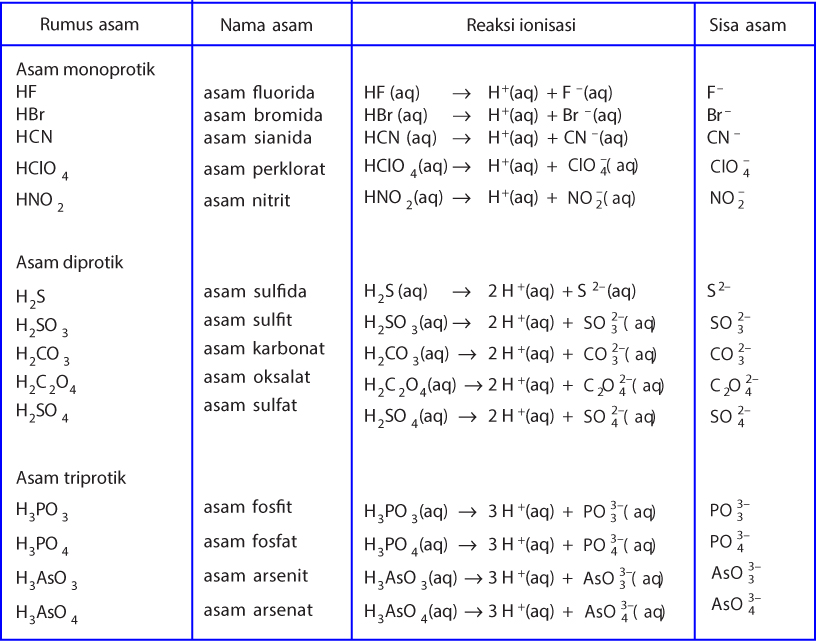
Ahli mengemukakan pendapatnya mengenai teori Asam Basa dengan pandangan berbeda. Berikut beberapa teori Asam Basa menurut tiga ahli: 1. Teori Asam Basa Arrhenius. Teori pertama dicetuskan pertama kali oleh seorang ahli kimia yang berasal dari Swedia bernama Svante Arrhenius. Teori tersebut mengorelasikan sifat keasaman dengan Ion Hidrogen atau.
PPT TEORI ASAM BASA PowerPoint Presentation, free download ID5368090
Teori Asam Basa Bronsted-Lowry dikemukakan oleh Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923. Teori ini dapat menjawab kekurangan yang terdapat pada teori Arhennius. Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry.
PPT TEORI ASAM BASA PowerPoint Presentation, free download ID3670924
Pembahasan. Ahli kimia yang berasal dari Swedia yaitu Svante Arrhenius menghubungkan sifat keasaman dengan ion hydrogen pada tahun 1884. Asam Arrhenius adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion dalam larutan, misalnya asam asetat dan HCl. Jadi, jawaban yang benar adalah Asam Arrhenius adalah zat yang apabila dilarutkan.

Konsep Asam Basa kimia A. Konsep Asam Basa Teori Asam Basa a. Teori Arrhenius Menurut
Menurut Arrhenius, suatu zat dikatakan asam jika dilarutkan dalam air akan menghasilkan ion H+, sebagai contoh yaitu disosiasi dari HCl. HCl → H + (Aq) + CI - (Aq) Saat HCl dibuat menjadi larutan, maka HCl terdisosiasi menjadi ion H+ dan ion Cl-. Karena sesuai dengan teori Arrhenius maka asam klorida termasuk asam Arrhenius.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Teori Asam Basa
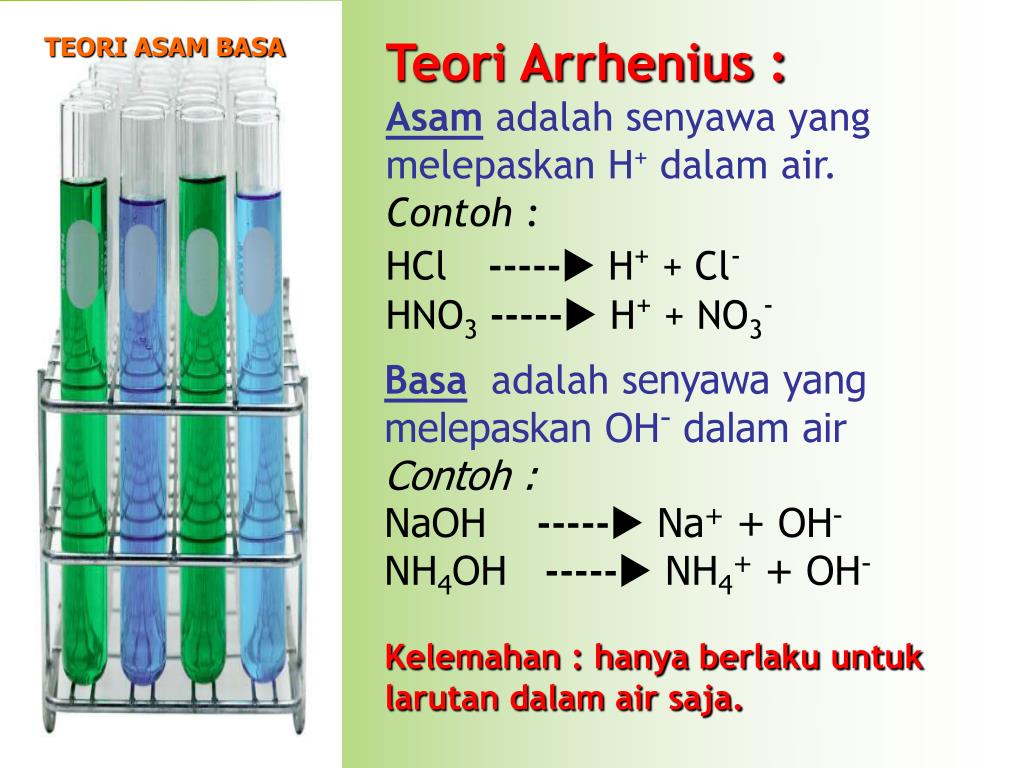
Sedangkan basa menurut Arrhenius adalah zat yang dapat menghasilkan ion hidroksida (OH-) ketika ditaruh di dalam air. Kendati bisa larut juga dalam air, basa ternyata memiliki perbedaan dengan asam ada pada ion yang dihasilkan nantinya.. Teori Asam Basa Menurut Lewis Dapat dikatakan bahwa teori ini lebih luas dibanding dua teori yang telah.
Teori Asam Basa Arrhenius dan PH Larutan Asam Basa ( file swf ) Ilmu Fisika and Biologi
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

Teori Asam Basa
Teori Asam-Basa menurut Brønsted-Lowry memberikan definisi yang lebih luas daripada teori Arrhenius, karena tidak terbatas pada larutan air. Menurut Brønsted-Lowry, asam adalah zat yang dapat menyumbangkan proton (H⁺) atau ion hidrogen dan basa adalah zat yang dapat menerima proton (H⁺).

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Menurut Teori Asam Basa Arrhenius bahwa Asam ialah Zat yang jika didalam Air dapat melepaskan Ion Hidrogen (H+), Ion - Ion Hidrogen yang dihasilkan oleh Asam tersebut ketika dilarutkan di dlm Air terikat pada Molekul - Molekul Air (H2O) dlm bentuk Ion Hidronium adalah Ion yang Positif yg dibentuk oleh sebuah Proton (Ion Hidrogen) pada.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Beberapa ilmuwan yang mengembangkan teori asam basa yaitu Arrhenius, Bronsted-Lowry, dan Lewis. Teori Asam Basa Lewis Pada tahun 1932 G. N. Lewis, seorang ahli kimia dari Amerika mengartikan asam sebagai suatu zat yang dapat menerima sepasang elektron, dan basa adalah zat yang dapat memberikan sepasang elektron.

Teori Asam dan Basa Menurut Arrhenius
Dijelaskan dalam Jurnal UNY, teori Arrhenius menyimpulkan: 1. Asam: zat/senyawa yang dapat menghasilkan H+ dalam air. HCl (aq) à H+ (aq) + Cl - (aq) 2. Basa: zat/senyawa yang dapat menghasilkan OH- dalam air. NaOH (aq) à Na+ (aq) + OH - (aq) • Reaksi netralisasi adalah reaksi antara asam dengan basa yang menghasilkan garam:

Teori Asam Basa
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.