
Ikatan Kovalen Dapat Terbentuk Antara Unsur Berbagai Unsur
Tidak dapat menghantarkan aliran listrik juga kecuali pada grafit atau karbon pada batu baterai dan dalam isi pensil. Hal ini menyebabkan ikatan kovalen jadi sangat kuat dan menyebabkan bentuk struktur raksasa yang membuat titik didihnya tergolong cukup tinggi.
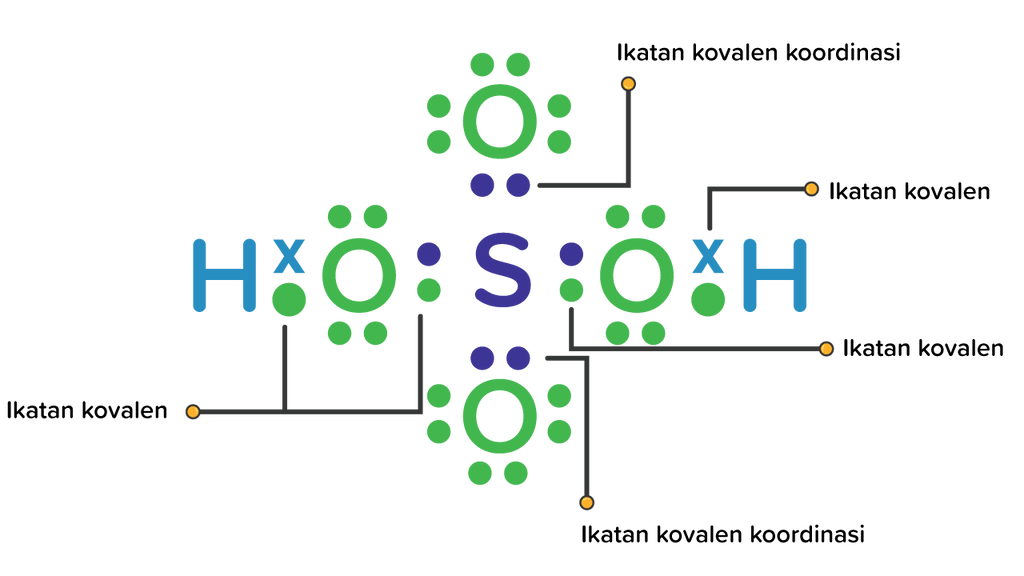
Apakah H 2 SO 4 termasuk senyawa kovalen dan dapat...
Pasangan elektron yang berbagi ini dikatakan dalam kondisi terikat, dimana mereka tidak dapat bergerak dari atom satu ke atom lainnya. Oleh karena itu, ikatan kovalen tidak dapat menghantarkan arus listrik. Untuk menjelaskan mengapa ikatan kovalen tidak dapat menghantarkan arus listrik, kita perlu memahami konsep dasar dari arus listrik.

Cara Pembentukan Ikatan Kovalen Senyawa NH3 (Amonia) YouTube
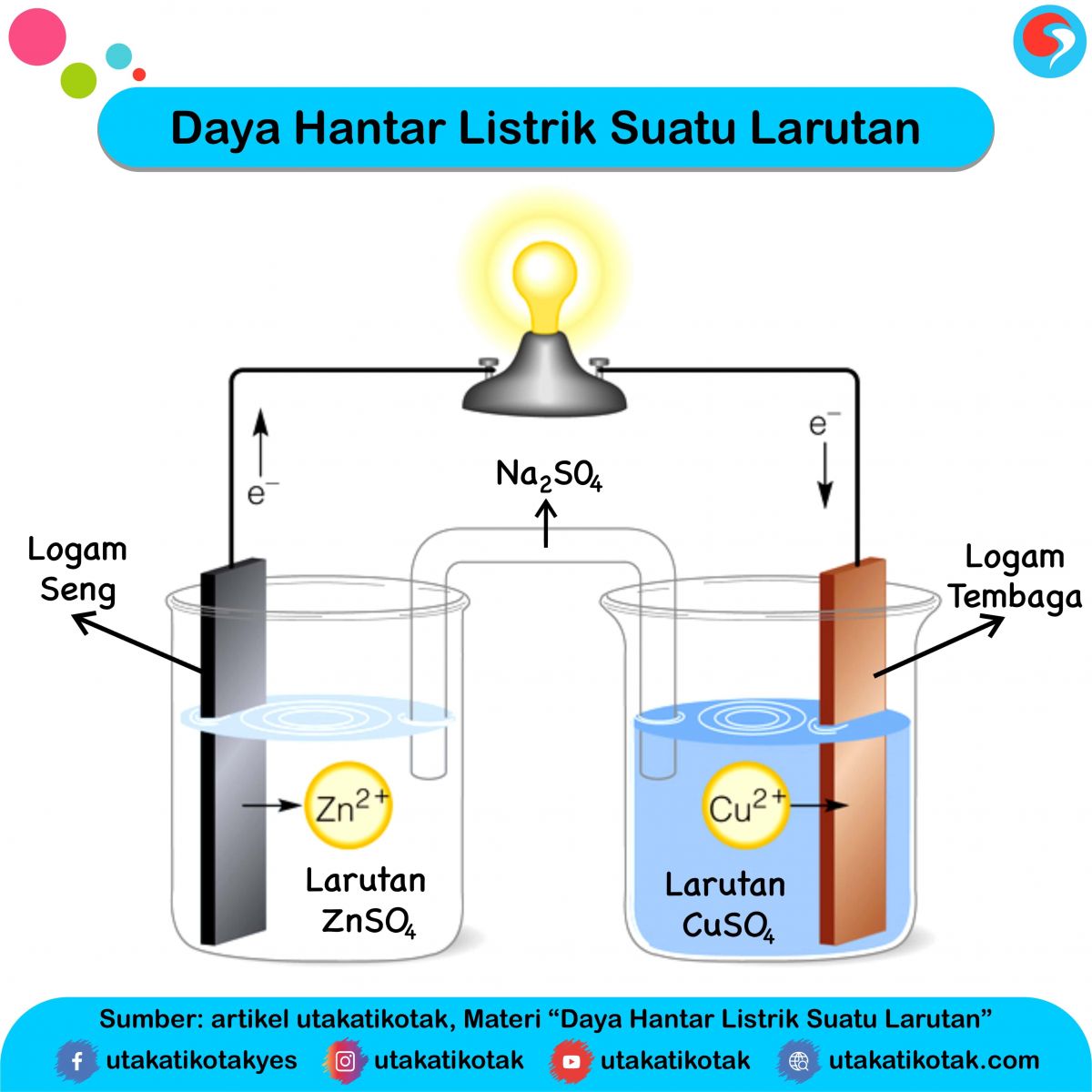
Senyawa kovalen polar dapat menghantarkan arus listrik karena dalam larutannya terionisasi menghasilkan ion-ion bermuatan yang bergerak bebas. Kemampuan suatu larutan dalam menghantarkan arus listrik disebabkan adanya ion-ion bermuatan (kation dan anion) yang bergerak bebas dalam larutannya. Ion-ion ini dihasilkan dari reaksi ionisasi maupun.

perbedaan senyawa ion dan kovalen dalam menghantarkan listrik Samantha Edmunds
Oleh karena itu, arus listrik tidak akan dapat mengalir melalui bahan. Kesimpulannya, lelehan senyawa kovalen polar tidak dapat menghantarkan listrik karena memiliki atom dengan muatan berbeda, ikatan kimia yang kuat, dan partikel-partikel yang tidak dapat bergerak melalui bahan. Jadi, bahan ini tidak dapat digunakan untuk menghantarkan listrik.

Materi Kimia kelas 10 Ikatan Kovalen Koordinasi dan Penyimpangan Kaidah Oktet _ Struktur SO3
Ikatan kovalen mempunyai titik leleh dan didih yang rendah. Ikatan kovalen tidak mudah larut dalam air, tetapi bisa larut dalam larutan organik. Ikatan kovalen tidak menghantarkan listrik. Ikatan kovalen berbentuk gas, cairan dan/atau padatan lunak pada suhu ruang. Keadaan ikatan kovalen murni bersifat isolator.
Jelaskan mengapa ikatan kovalen rangkap tiga lebih...
Senyawa kovalen polar murni seperti air suling (hasil destilasi) tidak dapat menghantarkan arus listrik karena kutub positif dan negatif, dipol itu, 'terkunci' dalam molekul oleh ikatan kovalen. You might be interested: Mengapa Kita Harus Mempelajari Akidah Islam?
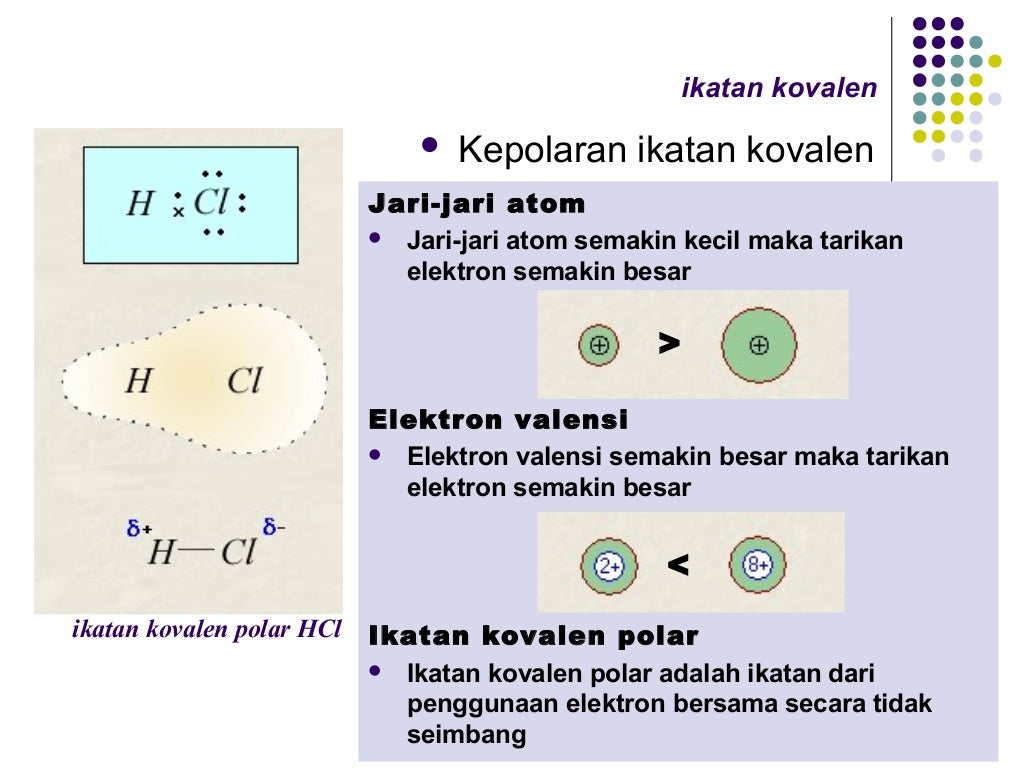
Ikatan kovalen
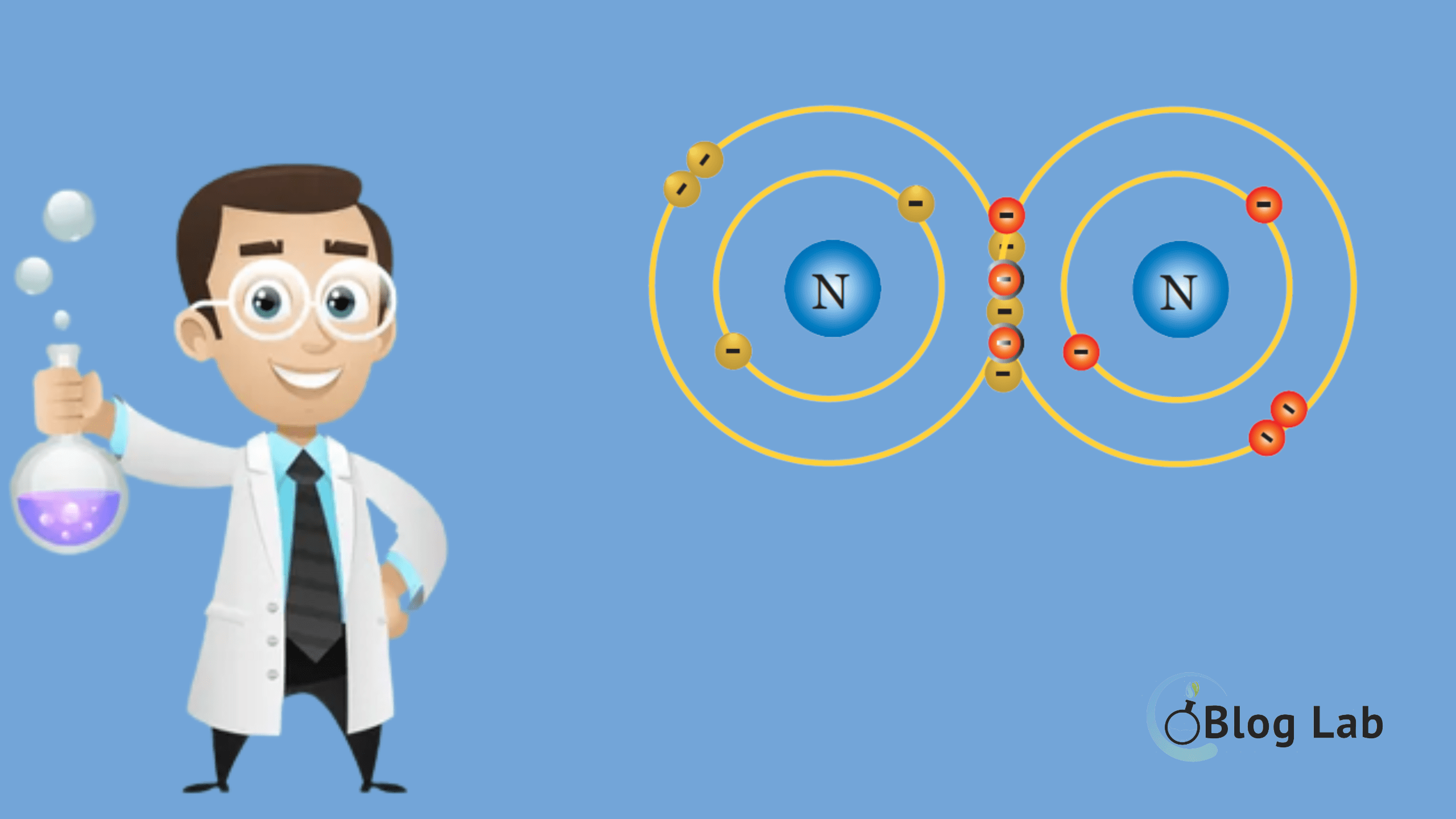
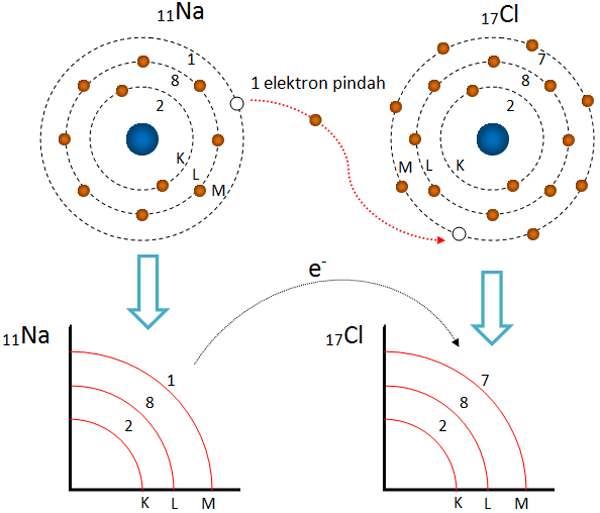
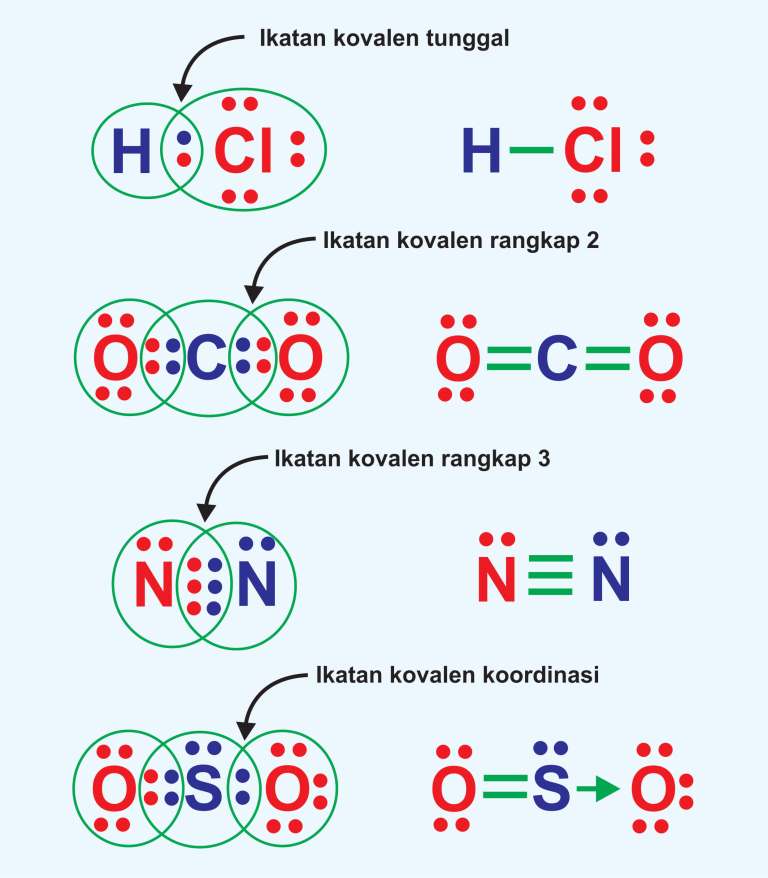
Ikatan kovalen tunggal terjadi ketika dua atom saling berbagi satu pasangan elektron untuk membentuk molekul yang stabil. Ini berbeda dengan ikatan ionik, di mana elektron ditransfer dari satu atom ke atom lain. Pada ikatan kovalen tunggal, kedua atom berkontribusi pada pasangan elektron yang dibagikan sehingga keduanya memperoleh konfigurasi.

Ikatan Kovalen PDF
Kecuali jika ikatan kovalen polar tersebut terputus secara heterolitik (pemutusan ikatan dengan pembagian elektron tidak sembang) hingga membentuk ion positif dan ion negatif, barulah senyawa itu dapat menghantarkan listrik. Misalnya HCl, ini senyawa kovalen polar. Dalam keadaan murni HCl secara teori tidak menghantarkan arus listrik, kecuali.
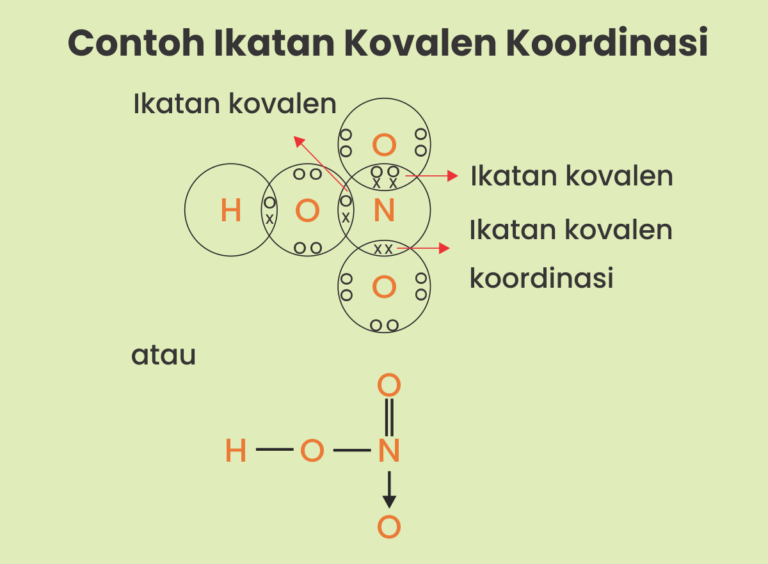
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
B. Daya Hantar Senyawa Kovalen Polar. Senyawa kovalen adalah senyawa yang terdiri dari atom-atom yang berikatan secara kovalen. Senyawa kovalen terdiri dari molekul-molekul bersifat netral dan tidak dapat menghantarkan listrik. Sehingga kebanyakan senyawa kovalen merupakan nonelektrolit. Dalam bentuk padatan atau lelehan, senyawa kovalen tidak.

Ikatan Kovalen Koordinasi, Kenali Pengertian dan Contohnya
Ikatan kovalen non polar adalah ikatan kovalen yang memiliki pasangan elektron dengan persebaran yang merata. Ciri-ciri ikatan kovalen non polar adalah sebagai berikut. Tidak terdapat perbedaan keelektronegatifan. Contoh: H2, N2, F2 Atom pusat tidak memiliki pasangan elektron bebas (PEB). Contoh: CH4, PCl5, dan BCl3 Bentuknya simetris. Contoh: CH2Cl2 Tidak dapat menghantarkan arus listrik
Pengertian dan Jenis Ikatan Kovalen
Senyawa kovalen terdiri dari molekul-molekul yang memiliki sifat netral dan tidak dapat menghantarkan listrik. Namun, mengapa pada senyawa kovalen HCl mampu menghantarkan listrik? Senyawa kovalen bersifat polar yang terdapat gaya tarik menarik untuk memutuskan ikatan-ikatan tertentu antar molekul. Sehingga, jika dilarutkan dalam air (pelarut.

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Meskipun senyawa-senyawa ini memiliki ikatan kovalen polar, mereka tidak menghasilkan ion-ion yang dapat menghantarkan listrik.. H 12 O 6 C_6H_{12}O_6 (glukosa), C 2 H 5 O H C_2H_5OH (etanol). Senyawa-senyawa ini tidak mengandung ion-ion bebas sehingga tidak dapat menghantarkan arus listrik.. (Cl⁻) dalam air, sehingga dapat.
Contoh Soal Ikatan Ion Dan Kovalen Contoh Soal Terbaru
1). Jenis ikatan yang dimiliki oleh larutan non-elektrolit adalah ikatan kovalen. Mengapa senyawa kovalen tidak dapat menghantarkan listrik? Pembahasan : Karena ketika berada dalam larutan, senyawa kovalen tidak dapat terionisasi. Shg tidak ada ion yang dapat menghantarkan arus listrik. 2).

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Pada umumnya, tidak menghantarkan listrik. Berupa cairan, gas, atau padatan lunak pada suhu ruang. Keadaan murni bersifat isolator. Jenis-jenis Ikatan Kovalen . Berikut adalah beberapa jenis ikatan kovalen berdasarkan jumlah pasangan elektron dan kepolarannya. 1. Jenis ikatan kovalen berdasarkan jumlah pasangan elektron
Pasangan Senyawa Mana Yang Dapat Menghantarkan Arus Listrik Dalam My XXX Hot Girl
Lain hal dengan larutan nonelektrolit. Larutan ini tidak dapat menghantarkan arus listrik sehingga tidak dapat menyalakan lampu dan tidak menimbulkan gelembung gas. Larutan nonelektrolit tidak dapat terionisasi dalam air (α = 0).
Dasar teori tentang ikatan kovalen
Baca juga: Jenis-jenis Ikatan Kovalen. Daya hantar listrik; Sebagian besar senyawa kovalen memiliki sifat non elektrolit atau tidak bisa menghantarkan arus listrik. Namun, senyawa kovalen polar memiliki sifat elektrolit dan dapat menghantarkan arus listrik dengan baik. Referensi: Hasan, M dan teman-teman. Ikatan Kimia. 2017.