
Prinsip Pembentukan Molekul dan Ion Ion dan Ikatan Ion, IPA Kelas 9 SMP Halaman 1 Kids
Maksudnya, ada zat yang melepas elektron dan ada yang menerima elektron di dalam sebuah reaksi redoks. Karena itulah nama reaksinya adalah reaksi reduksi-oksidasi atau reaksi redoks. Rumus umum reaksi redoks berdasarkan transfer elektron adalah sebagai berikut: A → An+ + n e (oksidasi) An+ + n e → A (reduksi)

Cara Konfigurasi Elektron Anion Fluor "9F" (Cara Mekanika Kuantum) YouTube
Saat kulit elektron terluar terisi penuh, unsur tersebut akan sulit untuk melepas maupun menerima elektron dari lingkungan sehingga stabil dan tidak mudah bereaksi. Baca juga: Menghitung Reaksi antara Asam Nitrat dan Gas Amonia . Untuk atom yang memiliki elektron valensi lebih atau kurang dari 8, maka atom tersebut akan berikatan dengan atom lain.

Trik Super Kilat Memahami Keelektronegatifan
Peristiwa Pada Ion. Peristiwa terurainya suatu zat menjadi ion-ion disebut ionisasi. Hasil ionisasi disebut ion. Elektron yang dapat keluar atau masuk ke suatu atom adalah elektron yang berada di kulit terluar. Ionisasi atom hanya terjadi pada atom-atom yang jumlah elektron paling luarnya tidak sama dengan 8, 18, atau 32.
Sifat Keperiodikan Unsur Titik Leleh Dan Titik Didih Berbagai Unsur
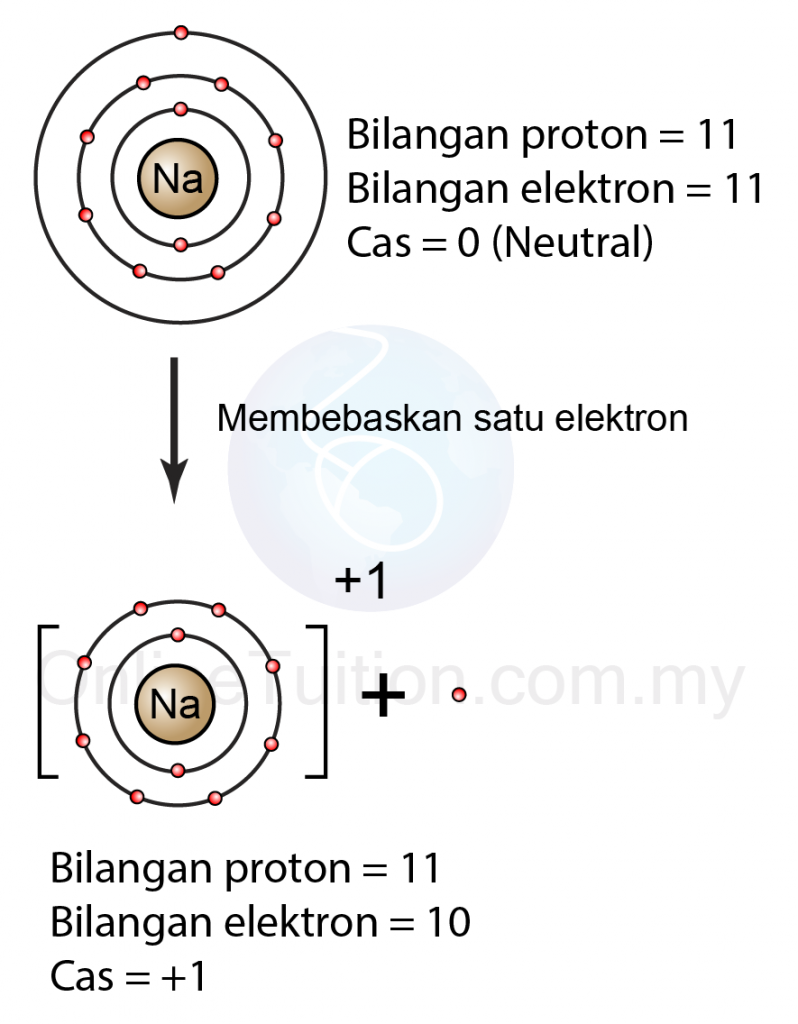
Pelepasan elektron menghasilkan ion positif dan penyerapan elektron menghasilkan ion negatif. Peristiwa terlepas atau masuknya ion pada sebuah atom disebut ionisasi . Contohnya, ketika atom natrium (Na) melepas satu elektron, maka akan membentuk ion Na + , atau ketika atom klorin (Cl) menerima 1 elektron, maka akan membentuk ion Cl - .
PPT IKATAN KIMIA PowerPoint Presentation, free download ID5631507
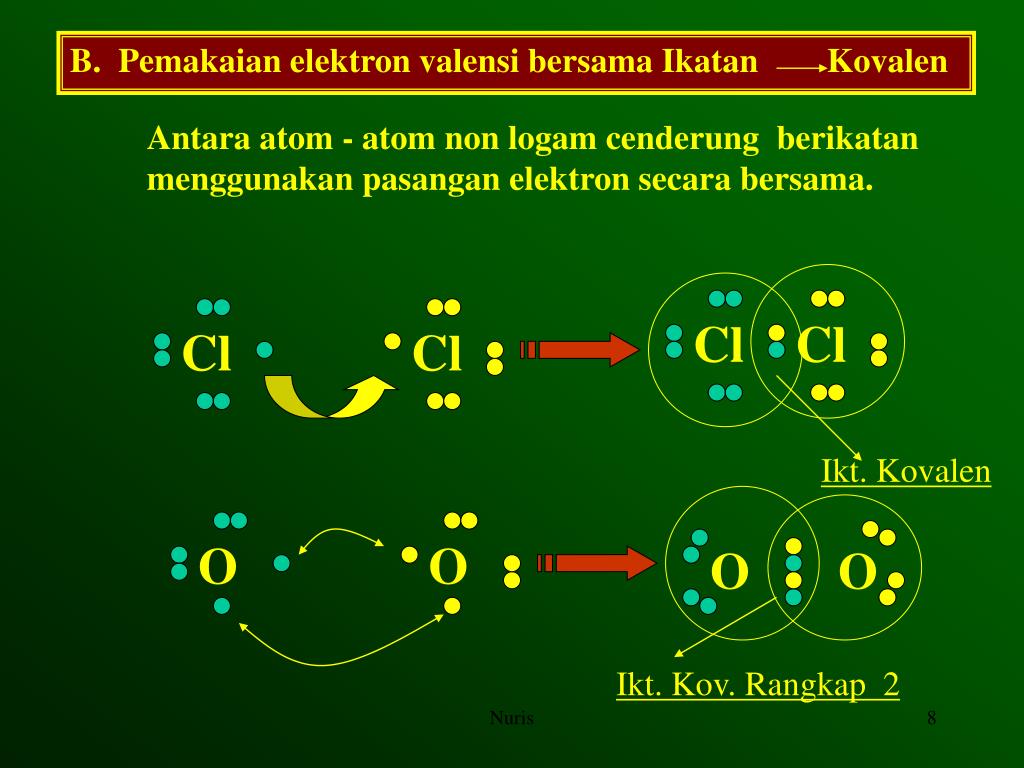
Sebagian atom cukup sulit melepas dan menerima elektron, untuk itu mereka perlu energi besar untuk memprosesnya. Maka terbentuklah konfigurasi elektron dimana atom saling berikatan lewat pemakaian pasangan elektron bersama yang terjadi pada atom nonlogam. Ikatan tersebut yang kita kenal dengan ikatan kovalen.

Unsur yang Paling Mudah Melepas Elektron YouTube
HNO 3 adalah asam.HNO 3 melepas proton (H+) menjadi NO 3 - yang merupakan basa konjugasi. H 2 O adalah basa.H 2 O menerima proton (H+) menjadi H 3 O + yang merupakan asam konjugasi.. Maka, HNO 3 dan NO 3 - merupakan pasangan asam basa konjugasi. Serta, H 2 O dan H 3 O + merupakan pasangan asam basa konjugasi. [inline_ads] 3. Zat Amfoter. Zat amfoter adalah suatu zat yang berperan sebagai.
Pembentukan Ion Kimia SPM
Terbentuknya ikatan kimia antar unsur terjadi karena adanya interaksi antar unsur yang saling melepas dan menerima elektron valensi atau membentuk pasangan elektron bersama. Gambaran terbentuknya ikatan kimia digambarkan dengan notasi yang disebut Struktur Lewis. Struktur Lewis dilambangkan dengan memberikan titik (.) atau silang (x) di sekitar lambang atom.

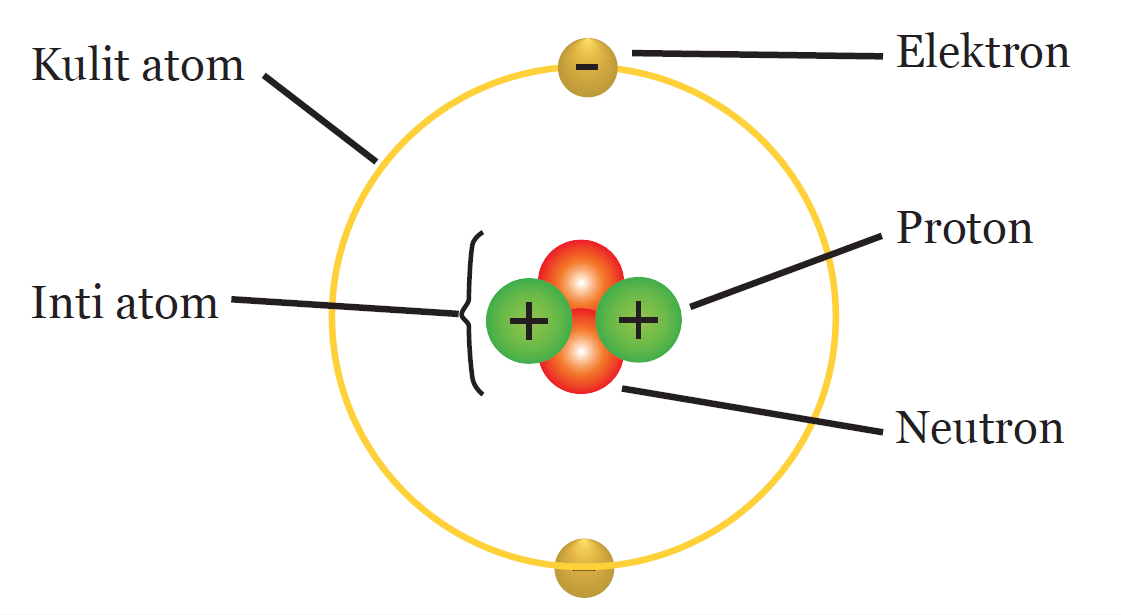
Atom,ion dan molekul
2Na → 2Na + + 2e - (oksidasi) Cl 2 + 2e - → 2Cl - (reduksi) Jadi jumlah transfer elektron atau perubahan bilangan oksidasi yang terjadi pada reaksi tersebut sama dengan 2. Pada contoh-2, jumlah elektron yang dilepas H 2 = 2, dan jumlah elektron yang diterima O 2 = 4, tampak bahwa jumlah elektron yang dilepas tidak sama dengan jumlah.

Ikatan Ion Beserta Contoh Ikatannya Rumus Kimia
Hal ini dapat dilakukan dengan dua cara yaitu dengan melepas atau menerima elektron, tergantung dengan kecenderungan dalam kemudahan dan kesulitan unsur tersebut menarik dan melepas elektron. Untuk unsur yang bersifat logam, dalam suatu periode dari kiri ke kanan akan semakin kurang reaktif namun dalam suatu golongan dari atas ke bawah akan.

Bagaimanakah tahapan Rantai Transfer Elektron dan Kemiosmosis? YouTube
transfer elektron serta perubahan bilangan oksidasi (Brady dan Jespersen, 2012). Ketiga konsep redoks ini merupakan konsep yang saling berhubungan. Ketiganya merupakan proses yang berpasangan dimana ada yang melepas dan ada yang menerima, serta melibatkan perubahan kimia dimana jumlah unsur/elektron yang
Partikel penyusun inti atom adalah Pasadena
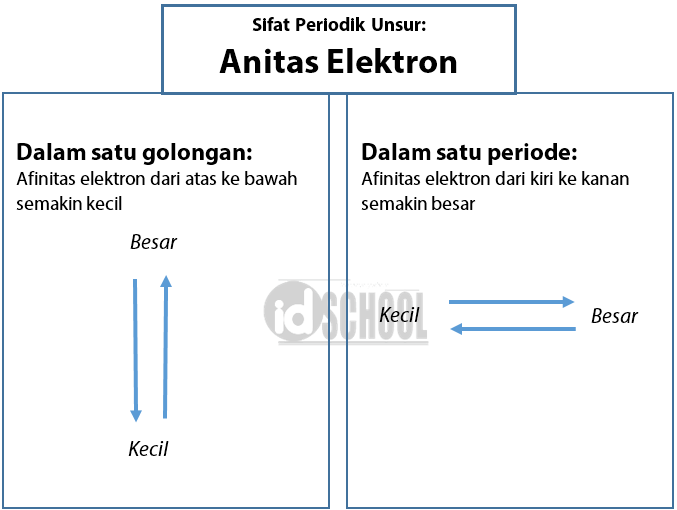
melepas dan menerima elektron Berdasarkan sifatnya, dalam sifat keperiodikan unsur, unsur atau atom dapat dibagi menjadi 3, yaitu unsur logam dan non logam serta metalloid.

PPT Materi Minggu ke3 IKATAN KIMIA PowerPoint Presentation, free download ID7082311
Pembahasan. Atom logam cenderung melepaskan elektron karena memiliki energi ionisasi yang kecil, sementara atom nonlogam cenderung menerima elektron karena memiliki afinitas elektron yang besar. Kecenderungan atom melepaskan atau menerima elektron dipengaruhi energi ionisasi dan afinitias elektron atom tersebut.

Soal Sma X Melepas Dan Menerima Elektron Plus Atau Minus 2 Q2 = 12μc = 12 x 10−6 c
Baca baik-baik ya! —. 1. Pengertian. Ikatan ion terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia. Ion positif dan ion negatif diikat oleh suatu gaya elektrostatik. Senyawa yang dihasilkan disebut senyawa ion.
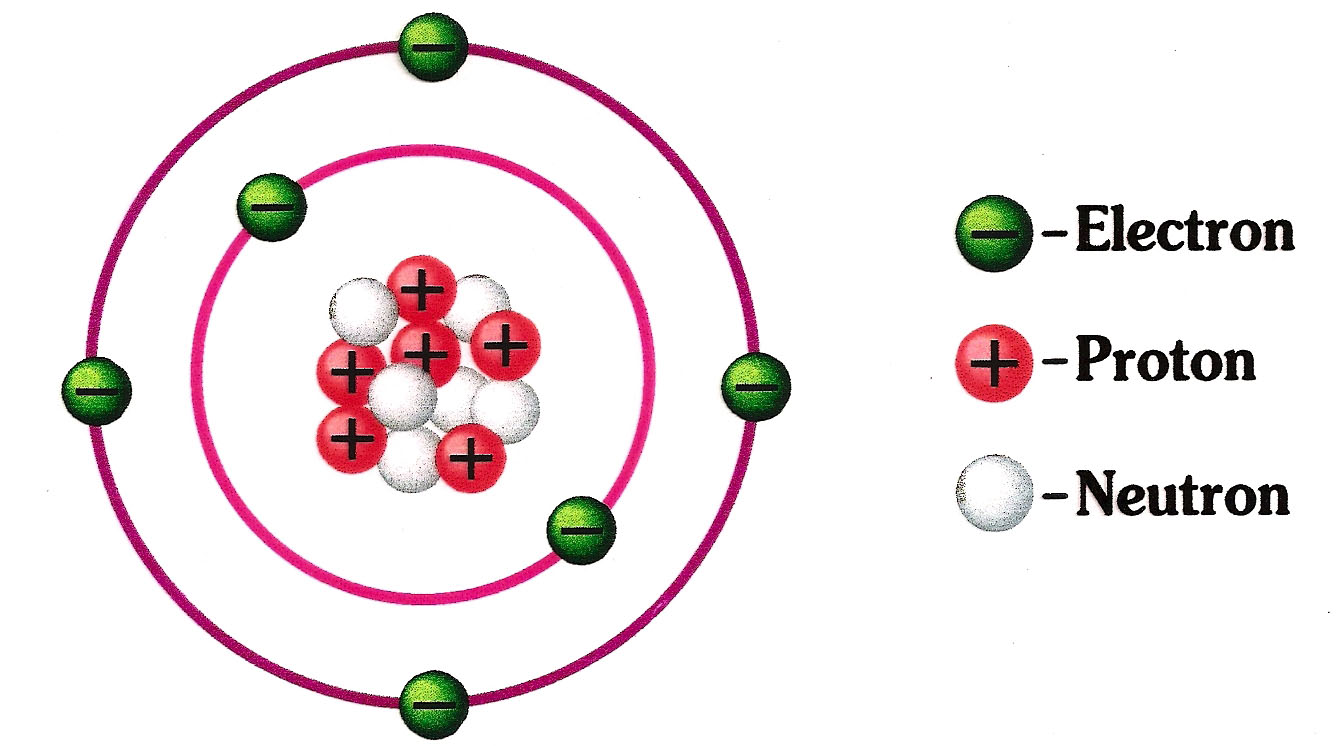
Pengertian Teori Elektron dalam Pembelajaran Elektronika ULBE Ulasan Lengkap Belajar Elektronika
Kestabilan ini bisa didapatkan dengan cara mendapatkan atau melepas elektron. Menurut Kossel dan Lewis, kestabilan atom ditentukan berdasarkan susunan atau konfigurasi elektron. Konfigurasi elektron akan stabil jika elektron terluarnya 2 (duplet) atau 8 (oktet). Hanya gas mulia yang memiliki konfigurasi elektron seperti ini.

Kelemahan Dan Kelebihan Model Atom Mekanika Kuantum Seputar Model
Atom dapat melakukan transfer elektron (melepas/menerima elektron) melalui cara berikut: Menambah elektron agar elektron terluar menjadi 8. Melepas semua elektron terluar (elektron valensi) Adanya proses transfer elektron menyebabkan terbentuk ion positif atau ion negatif. Unsur golongan IA, IIA, IIIA akan cenderung melepaskan elektron.
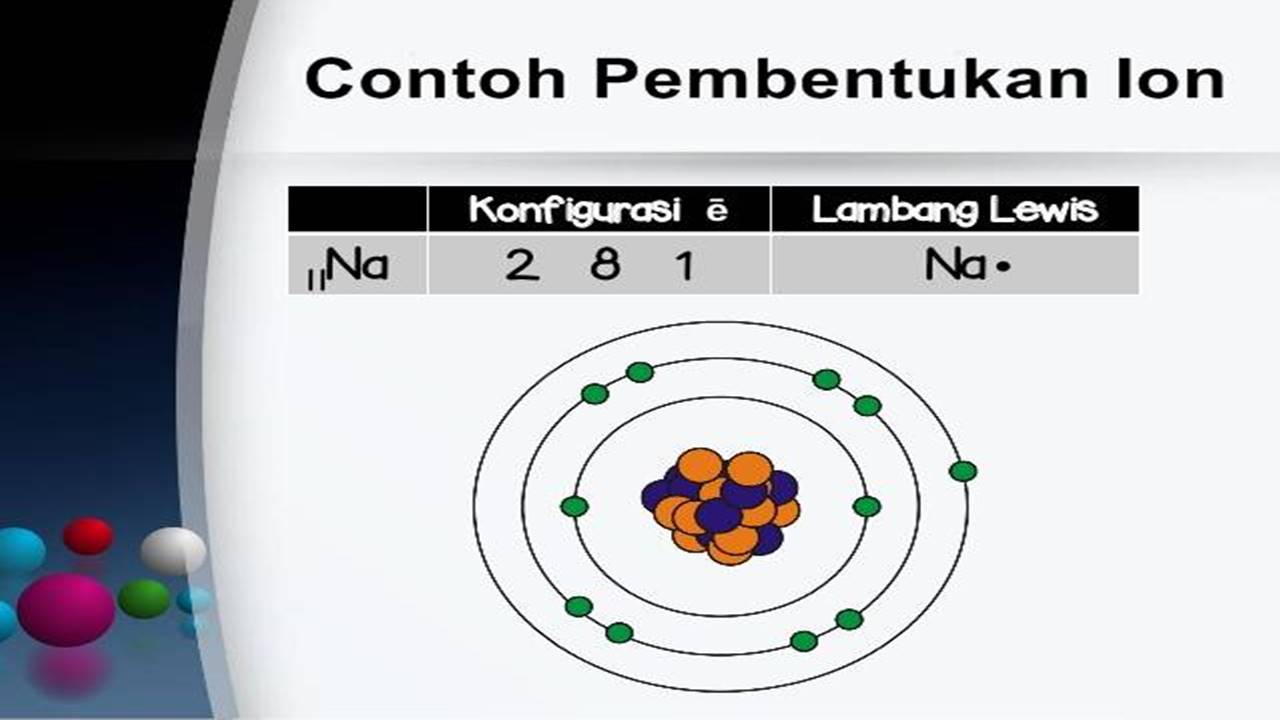
Pembentukan Ion
Pada kenyataannya, Reaksi Reduksi Oksidasi melepas dan menerima elektron berlangsung secara bersamaan. Ketika sebuah zat mengalami oksidasi dengan cara melepaskan elektron, zat lain dalam reaksi akan menerima elektron tersebut sehingga mengalami reduksi. Contoh Konsep Pelepasan dan Penerimaan Elektron Reaksi Redoks: 1.