
Persamaan Laju Reaksi dan Orde Reaksi Your Chemistry A+
Selain itu, dari aplikasinya dalam reaksi transesterifikasi, dapat disimpulkan bahwa hasil prosentasi yield biodiesel terbesar yaitu pada reaksi transesterifikasi yang dikatalis oleh CaOCeO2 View.

WANIBESAK Makna Orde Reaksi dalam Laju Reaksi
Materi kimia SMA kelas XI tentang Macam-macam Orde Reaksi.Pembahasan meliputi pengertian orde reaksi, macam-macam orde reaksi, dan grafik orde reaksi. Orde.

CARA MENCARI ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA PERCOBAAN TIDAK ADA YANG SAMA !!
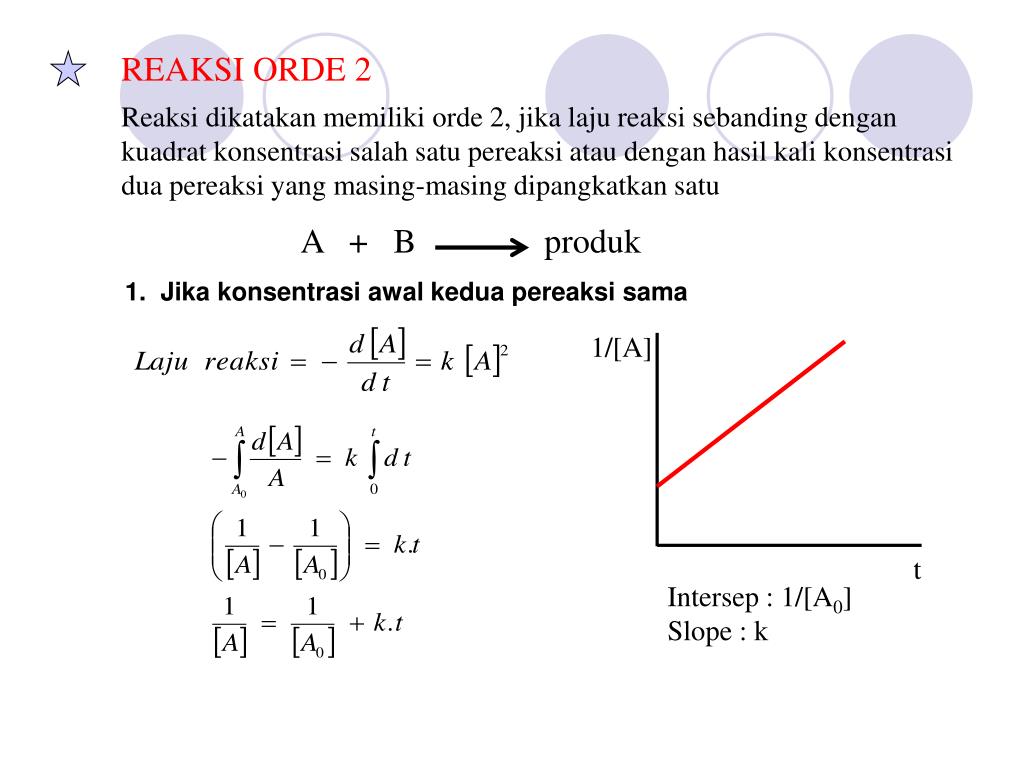
Orde suatu reaksi kimia adalah jumlah nilai x dan y.Reaksi orde kedua adalah reaksi di mana x + y = 2. Hal ini dapat terjadi jika satu reaktan dikonsumsi dengan laju yang sebanding dengan kuadrat konsentrasi reaktan (laju = k[A] 2) atau kedua reaktan dikonsumsi secara linier dari waktu ke waktu (laju = k[A][B]). Satuan konstanta laju, k, dari reaksi orde kedua adalah M -1 ·s -1.

Orde reaksi NO dan Br2 berdasarkan data reaksi berikut. 2...
Reaksi kimia adalah suatu proses di mana satu atau lebih zat, diubah menjadi satu atau zat yang berbeda dan menghasilkan produk yang baru. Zat adalah unsur atau senyawa kimia. Reaksi kimia mengatur ulang atom reaktan untuk membuat zat yang berbeda. Reaksi kimia umumnya terjadi dengan perubahan fisik, produksi panas, perubahan warna dll.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Bagaimana Mengklasifikasikan Orde Reaksi Kimia Menggunakan Kinetika. Reaksi kimia dapat diklasifikasikan berdasarkan kinetika reaksinya , studi tentang laju reaksi. Teori kinetik menyatakan bahwa partikel kecil dari semua materi bergerak konstan dan bahwa suhu suatu zat bergantung pada kecepatan gerakan ini.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA YANG DIKETAHUI WAKTU YouTube
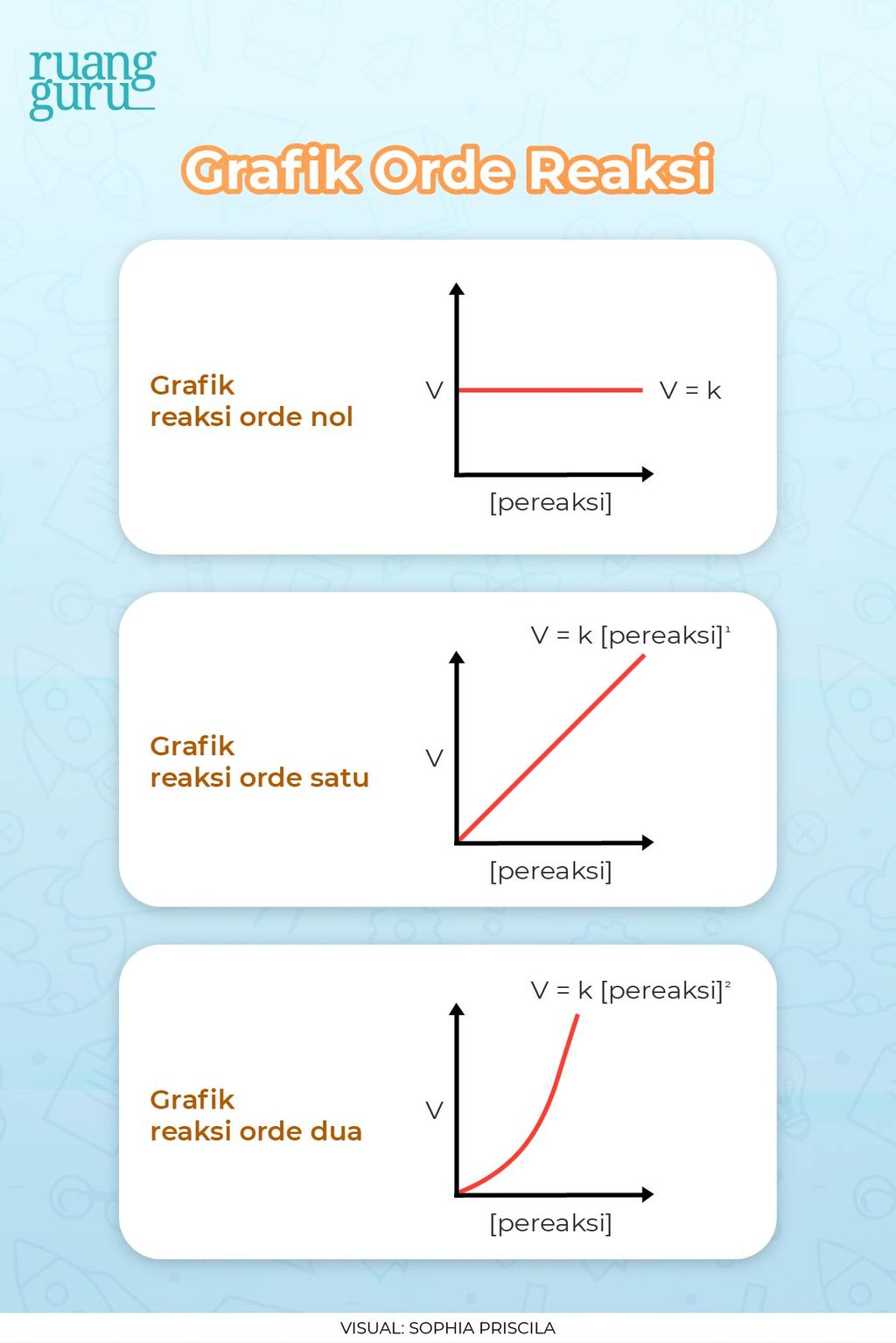
Ada tiga macam grafik orde reaksi, nih. Pertama yaitu orde reaksi nol. Grafik ini menunjukkan bahwa laju reaksi tidak bergantung pada konsentrasi reaksi. Baca juga: Sifat-Sifat Koloid dan Cara Pembuatannya. Pada grafik orde satu, laju reaksi itu punya perbandingan yang lurus dengan konsentrasi pereaksi. Kalau konsentrasi tersebut dinaikkan dua.

Menentukan Orde Reaksi Laju reaksi kimia kelas 11 YouTube
Pada video ini dibahas mengenai cara menentukan Orde Reaksi berdasarkan Metode Substitusi, Grafik, dan Waktu Paruh#ordereaksi#waktuparuh#lajureaksi
PPT REAKSI PowerPoint Presentation, free download ID4712632
A. Pengertian Orde Reaksi Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi pada laju reaksi. B. Rumus Orde Reaksi Beberapa orde reaksi yang umum terdapat dalam persamaan reaksi kimia beserta rumusnya adalah sebagai berikut. 1. Reaksi Orde Nol (0) Suatu reaksi kimia dikatakan mempunyai orde reaksi nol, jika besarnya laju reaksi tersebut tidak dipengaruhi oleh konsentrasi
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
Salah satunya, dari tahap-tahap reaksi elementer. Jika hal tersebut diketahui, maka orde reaksi sama dengan koefisien reaksi tahap paling lambat. Namun bila tak diketahui, maka orde reaksi ditentukan melalui eksperimen. Terdapat tiga macam orde reaksi yang umumnya dijumpai dalam persamaan laju reaksi. Ketiganya ialah Reaksi Orde Nol, Reaksi.

Menentukan Orde, harga K , dan Laju Reaksi KIMIA SMA YouTube
Nilai suatu orde reaksi dapat berupa bilangan positif, pecahan, nol,atau negatif.Secara matematis, nilai orde reaksi total adalah penjumlahan orde reaksi seluruh zat reaktan. Contoh: Macam-macam orde reaksi total beserta grafik dijelaskan pada gambar di bawah ini: a. Orde reaksi total nol Pada orde reaksi nol, laju reaksi tidak dipengaruhi oleh.

Menghitung Orde Reaksi Total dari Suatu Reaksi YouTube
Latihan Soal Orde Reaksi & Waktu Paruh (Sukar) Apabila kita gunakan konsentrasi reaktan 0.5 M maka waktu reaksi yang terukur adalah. . Belajar Modul, Rumus, & Soal Orde Reaksi & Waktu Paruh dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Orde Reaksi & Waktu Paruh lengkap di Wardaya College.

Mengenali Reaksi Kimia
Orde Reaksi Dalam bidang kinetika kimia, orde reaksi suatu substansi (seperti reaktan, katalis atau produk) adalah banyaknya faktor konsentrasi yang mempengaruhi kecepatan reaksi. Untuk persamaan laju reaksi: r = k [A]x [B]y ([A], [B],. adalah konsentrasi), orde reaksinya adalah x untuk A dan y untuk B. Orde reaksi secara keseluruhan adalah jumlah sum x […]

Cara Menentukan Orde Reaksi Perlu Melalui Percobaan
Orde pertama. Jika laju reaksi bergantung pada satu reaktan dan jumlah eksponennya satu, maka reaksi itu adalah reaksi orde pertama. Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair ArN 2 + + X − → ArX + N 2, persamaannya adalah r = k[ArN 2 +], dan Ar merupakan kelompok aril. Contoh reaksi orde pertama lainnya adalah proses peluruhan radioaktif.

Cara Menentukan Orde dari Suatu Reaksi Kimia YouTube
Reaksi pembakaran adalah jenis reaksi redoks di mana bahan yang mudah terbakar bergabung dengan oksidator untuk membentuk produk teroksidasi dan menghasilkan panas ( reaksi eksotermik ). Biasanya, dalam reaksi pembakaran oksigen bergabung dengan senyawa lain untuk membentuk karbon dioksida dan air. Contoh reaksi pembakaran adalah pembakaran.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA ADA YANG TIDAK SAMA YouTube
Maka diperoleh bahwa orde reaksi Natrium monoksida (NO) adalah 2 dan orde reaksi bromin (Br2) adalah 1. Tentukan tetapan persamaan laju reaksi Nitrosil bromida (NOBr2) menggunakan data percobaan yang pertama: Jadi, kecepatan laju reaksi pembentukan Bromin adalah sebesar 6 molar per detik. Hal ini berarti pada reaksi antara Natrium monoksida dan.

Orde reaksi total laju reaksikimia SMA YouTube
Reaksi Orde Tiga. Pada reaksi orde tiga terdapat tiga kasus berbeda yaitu: Tipe 1: Laju reaksi berbanding langsung dengan pangkat tiga konsentrasi dari reaktan.. 3 A → Produk. Tipe 2 : Laju reaksi sebanding dengan kuadrat konsentrasi dari reaktan pertama dan pangkat satu dari konsentrasi reaktan kedua. 1. Untuk reaksi : A + B → Produk. 2. Untuk reaksi : 2A +B → Produk