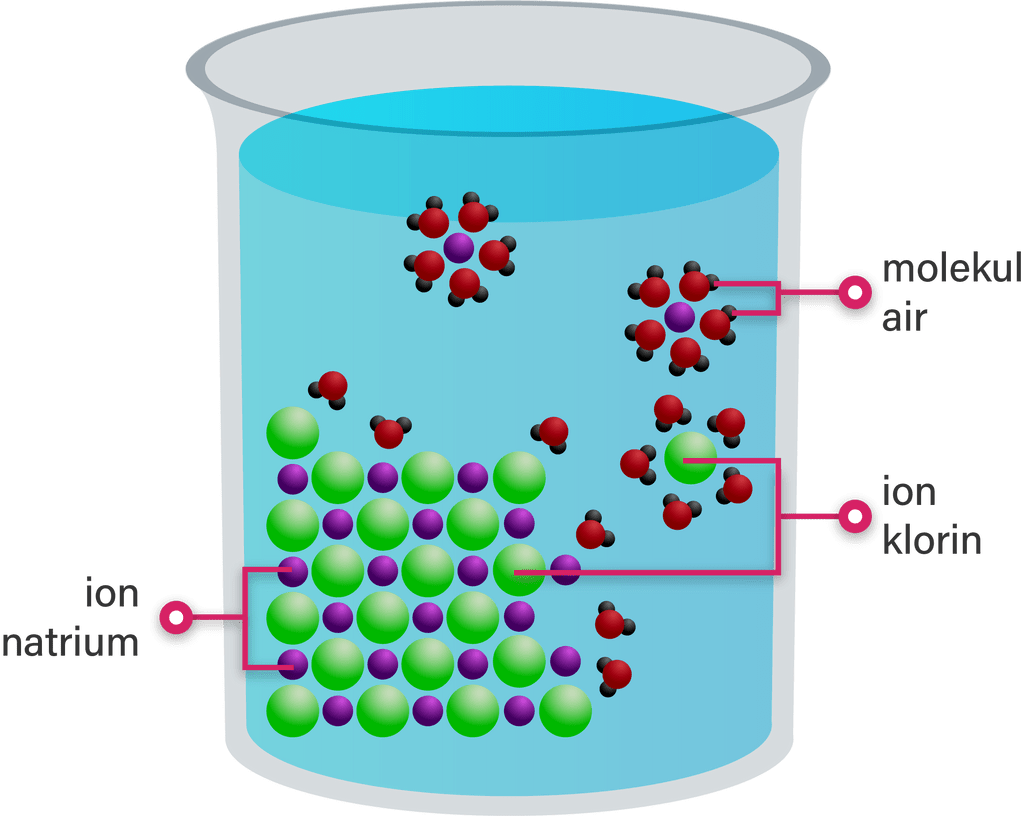
Senyawa ionik dalam larutan terurai menjadi ionio...
larutan NaCI sangat encer kurang dari 0,01 M, daya hantarnya diharapkan sesuai dengan disosiasi garam ke dalam ion-ionnya, tetapi jika konsentrasi larutan besar perbedaan antara harapan dan amatan menjadi lebih besar. Penyebabnya, ion-ion berlawanan muatan mengadakan baku tarik satu sama
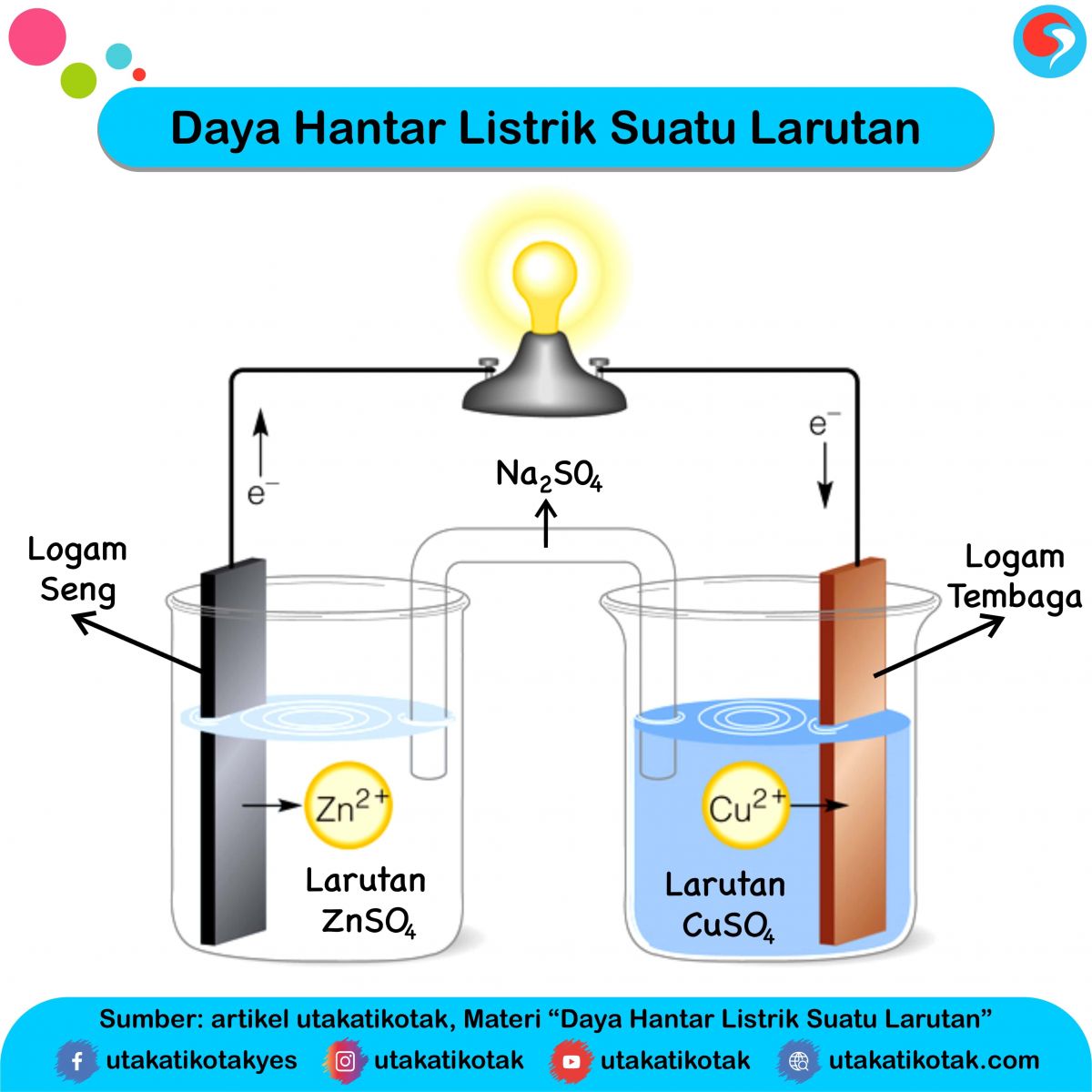
Daya Hantar Listrik Suatu Larutan
Larutan elektrolit cenderung membentuk larutan yang dapat menghantarkan listrik. Mengalami perubahan optik karena interaksi ion dengan molekul pelarut. Sifat Larutan Non Elektrolit. Larutan non elektrolit tidak dapat memisahkan diri menjadi ion-positif dan ion-negatif karena molekulnya tetap utuh dalam larutan. Larutan non elektrolit memiliki.

Suatu larutan mengandung ion Ca^2+, Sn^2+, Hg^2+, Ba^2+,
Dengan demikian, kita mendapati bahwa jumlah ion terlarutnya menjadi dua ion. Baca Juga: Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya. Sementara itu, larutan nonelektrolit kebalikannya, nih. Larutan nonelektrolit tidak dapat menghantarkan arus listrik karena molekul-molekul terlarutnya tidak terionisasi di dalam larutanya.

Bagian 2 Larutan Asam Basa Kesetimbangan Ion dalam Larutan YouTube
Kekuatan ion. Konsep kekuatan ion pertama kali diperkenalkan Lewis dan Randall pada tahun 1921 ketika menjelaskan koefisien aktivitas elektrolit kuat. [1] Kekuatan ion suatu larutan adalah ukuran konsentrasi ion dalam larutan tersebut. Senyawa ionik, ketika dilarutkan dalam air, terdisosiasi menjadi ion-ion. Konsentrasi elektrolit total dalam.

Kesetimbangan Ion Dan PH Larutan PDF
Istilah ion pertamakali diperkenalkan oleh ahli kimia dan fisika inggris Michael Faraday pada tahun 1834 dimana pada saat itu dia menggambarkan spesies kimia yang bergerak dari satu elektroda ke elektroda yang lain dalam larutan berair. Kata ion berasal dari bahasa Yunani dimana ion atau ienai yang berarti "pergi".

Kesetimbangan IonIon dalam Larutan Praktikum Kimia Larutan YouTube
Sedangkan larutan non elektrolit adalah senyawa yang tidak terionisasi sama sekali dalam larutan, tidak terdapat ion-ion di dalam larutan, zat hanya berupa molekul yang tidak bermuatan listrik. Tidak adanya aliran muatan dari pergerakan ion-ion, menyebabkan larutan yang mengandung non elektrolit tidak dapat menghantarkan listrik. 3.
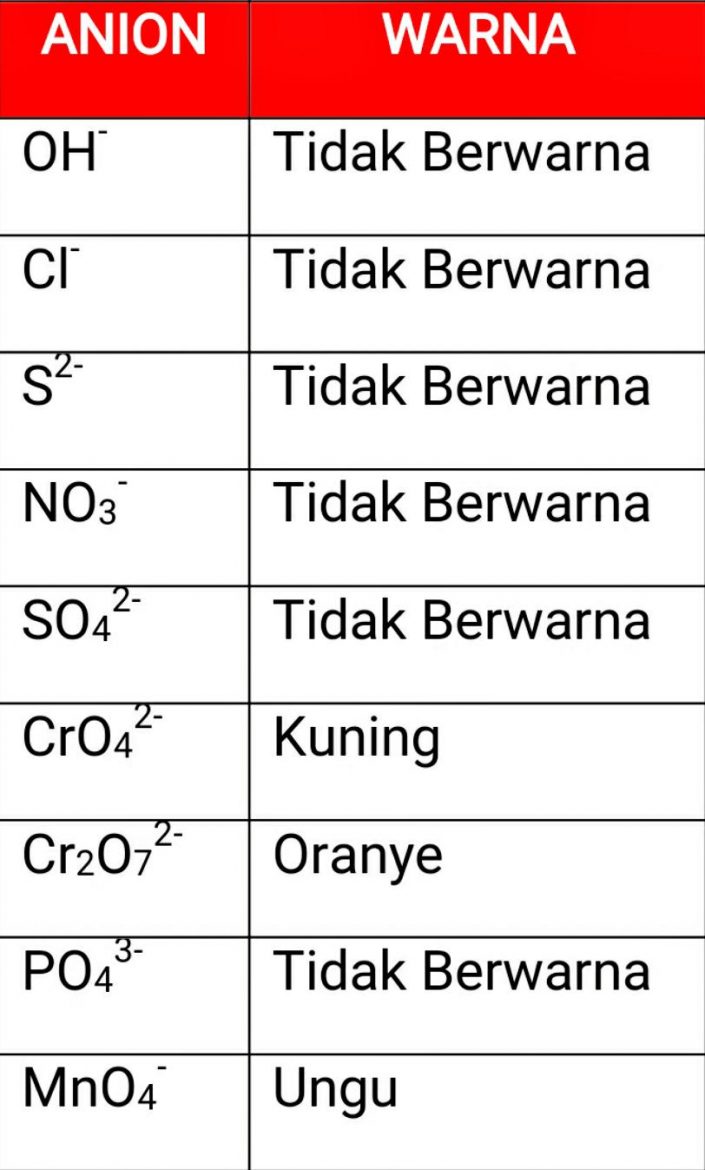
ION DAN WARNA ION DALAM LARUTAN Bisakimia
Pelarutan Senyawa Ionik dan Kovalen. Ngomong-ngomong tentang larutan, terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. Nah, yang namanya interaksi, berarti kita akan nyerempet-nyerempet ke jenis ikatan kimia, seperti ikatan ionik, kovalen, polar, dan nonpolar. Contohnya larutan garam (NaCl) dilarutkan oleh air.

Kesetimbangan Larutan Ion dan Asam Basa Kelas 11 XI Kimia SMA / SMK Detail Catatan MejaKita
Bila senyawa ion larut, ion individu terdisosiasi (tersebar), tersolvasi (berinteraksi dengan pelarut), dan tersebar di seluruh larutan yang dihasilkan. Karena ion menjadi lepas di dalam larutan saat dilarutkan dan dapat membawa muatan, larutannya senyawa ion memiliki konduktivitas listrik tinggi, dan senyawa tersebut adalah jenis elektrolit.
cikgu zai.kimia ELEKTROLISIS LARUTAN AKUEUS FAKTOR KEDUDUKAN ION DALAM SIRI ELEKTROKIMIA
Ion adalah suatu atom atau molekul yang memiliki muatan listrik total tidak nol. zat tersebut telah bergerak melalui larutan dalam suatu arus. Ion ini membawa materi dari satu tempat ke tempat lain. Faraday juga memperkenalkan kata anion untuk ion bermuatan negatif, dan kation untuk ion bermuatan positif.

Perbedaan Senyawa Ion Dan Kovalen Polar Dalam Larutan Elektrolit 2).senyawa kovalen polar
Contoh elektrolit kuat adalah asam sulfat (air aki) dan natrium klorida (garam dapur). Larutan elektrolit lemah, merupakan elektrolit yang punya kekuatan daya hantar listrik lemah, hal ini disebabkan karena hanya sebagian kecil molekulnya saja yang terurai menjadi ion-ion. Nilai α pada larutan ini berada diantara 0 dan 1 (0 < α < 1).

Cara Menghitung Ph Larutan Asam Kuat Dan Asam Lemah Panduan Kimia Riset Sexiz Pix
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi. Baca juga.

Cara Membuat Larutan Iodium 0.1 N (0.05 M) JAGAD KIMIA
Istilah "ion" diperkenalkan oleh ahli kimia dan fisika Inggris Michael Faraday pada tahun 1834 untuk menggambarkan spesies kimia yang bergerak dari satu elektroda ke elektroda yang lain dalam larutan berair. Kata ion berasal dari kata Yunani ion atau ienai, yang berarti "pergi."

Kesetimbangan IonIon dalam Larutan
Larutan non elektrolit adalah larutan yang gak menghasilkan ion-ion setelah dilarutkan. Singkatnya, setiap larutan asam, basa, dan garam yang dilarutkan ke dalam air akan mengalami ionisasi, sehingga dikatakan sebagai larutan elektrolit. Sedangkan senyawa lainnya adalah non elektrolit. Contoh Soal 2.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Larutan elektrolit adalah larutan yang bisa menghantarkan arus listrik karena zat dapat terurai menjadi ion positif dan ion negatif. Larutan ini dibagi menjadi larutan elektrolit kuat dan elektrolit lemah dilihat dari kekuatan daya hantar listriknya. Larutan elektrolit kuat misalnya HCl, KCl, dan sebagainya.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
Contoh Soal Identifikasi Kation dan Anion Beserta Pembahasannya. 1. Jelaskan bagaimana cara identifikasi kation dan anion berikut : Na +, K + Pb2 +, Ag +, CO2 − 3, dan I −. Pengujuian ion natrium dan kalium dapat dilakukan dengan cara uji nyala:
cikgu zai.kimia ELEKTROLISIS LARUTAN AKUEUS FAKTOR KEDUDUKAN ION DALAM SIRI ELEKTROKIMIA
Pemisahan dilakukan dengan cara menambahkan larutan elektrolit lain yang mampu berikatan dengan ion-ion dalam larutan yang sudah tercampur tadi. Quipperian harus ingat bahwa kelarutan setiap zat berbeda-beda. Artinya, ada zat yang cepat mengendap dan ada pula yang tidak. Nah, endapan itulah yang nantinya dipisahkan dari pelarut.