Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Tetapan kenaikan titik d.

Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
ΔTb = m × Kb. Titik didih larutan = 100 °C + 5,2 °C = 105,2 °C. Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. 2. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka. tentukan massa molekul relatif naftalena! 3.

Cara Menghitung Kenaikan Titik Didih Pada Larutan Elektrolit Reverasite
Sifat koligatif sendiri hanya memandang "kuantitas", bukan "kualitas". Oleh sebab itu, sifat larutan, seperti rasa, warna, dan kekentalan (viskositas) merupakan sifat-sifat yang bergantung pada jenis zat terlarut yang tercampur dalam larutan. Terdapat empat sifat koligatif larutan, yaitu penurunan tekanan upa, kenaikan titik didih.

Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih YouTube
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. [3] Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.

Tetapan kenaikan titik didih molal (Kb) tergantung pada . . . . YouTube
Larutan urea 0,1 molal dalam air mendidih pada suhu 100,05 °C. Pada volume yang sama, larutan glukosa 0,1 molal dan sukrosa 0,3 molal dicampurkan. Hitung titik didih campuran tersebut!

Kenaikan Titik Didih PDF
K f Kf : Tetapan penurunan titik beku molal (°C/molal) Kenaikan Titik Didih. Kenaikan titik didih sebuah larutan bergantung pada keberadaan partikel terlarut dan jumlahnya,bukan pada jenis zat tersebut. Sifat ini merupakan efek dari pengenceran pelarut karena adanya zat terlarut. Titik didih zat cair adalah suhu tetap saat zat cair.

SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH YouTube
Kenaikan titik didih adalah fenomena yang terjadi untuk semua zat terlarut dalam semua larutan, bahkan dalam larutan ideal, dan tidak bergantung pada interaksi zat terlarut-pelarut tertentu. Peningkatan titik didih terjadi baik ketika zat terlarut adalah suatu elektrolit , seperti berbagai garam, dan nonelektrolit.

Kumpulan Contoh Soal Kenaikan Titik Didih Kimia Kelas 12 CoLearn halaman 17
Kenaikan titik didih adalah sifat koligatif, yang berarti bahwa kenaikan titik didih bergantung pada keberadaan partikel terlarut dan jumlahnya, tetapi tidak pada jenis zat tersebut.. D. Faktor-faktor yang mempengaruhi Titik Didih. 1. Konsentrasi ( molal ) zat terlarut mempengaruhi kenaikan titik didih, dimana semakin besar konsentrasi.
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
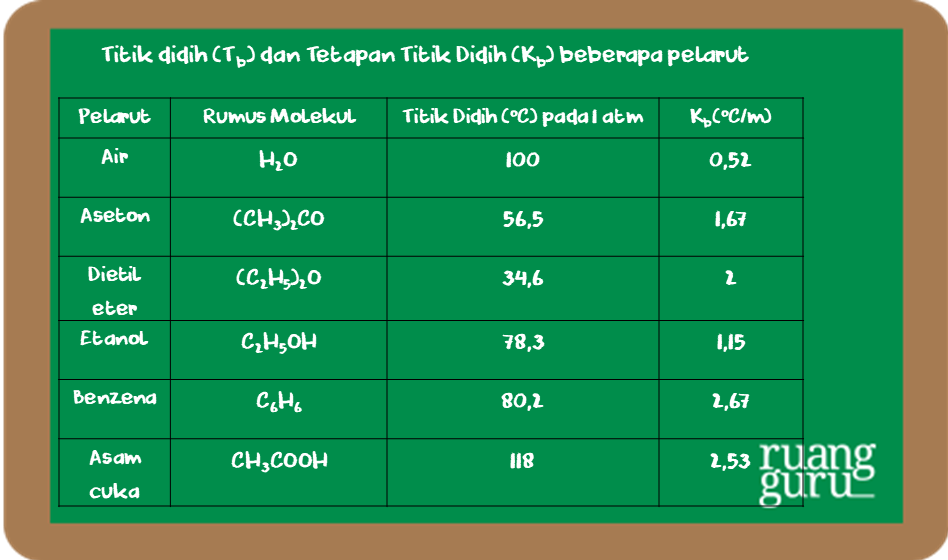
ini kita akan membahas mengenai tetapan kenaikan titik didih molal atau KB di mana pertanyaannya adalah tetapan kenaikan titik didih molal atau KB bergantung pada titik didih pelarut B molalitas larutan C jenis pelarut molaritas larutan perbedaan titik beku dan titik didih larutan diketahui jika kita menggunakan dua jenis pelarut yang berbeda maka nilai KB nya akan berbeda pula misalnya di.

kenaikan titik didih(penjelasan di deskripsi) YouTube
Tb = 100°C + ΔTb. = 100°C + 0,0416°C = 100,0416°C. Jadi, Tidik didih larutan tersebut yaitu 100,0416°C. Itulah ulasan mengenai √ Titik Didih : Pengertian, Kenaikan, Faktor, Rumus & Contoh Soalnya Lengkap. Semoga apa yang telah diulas dapat bermanfaat bagi pembaca. Sekian dan terima kasih.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
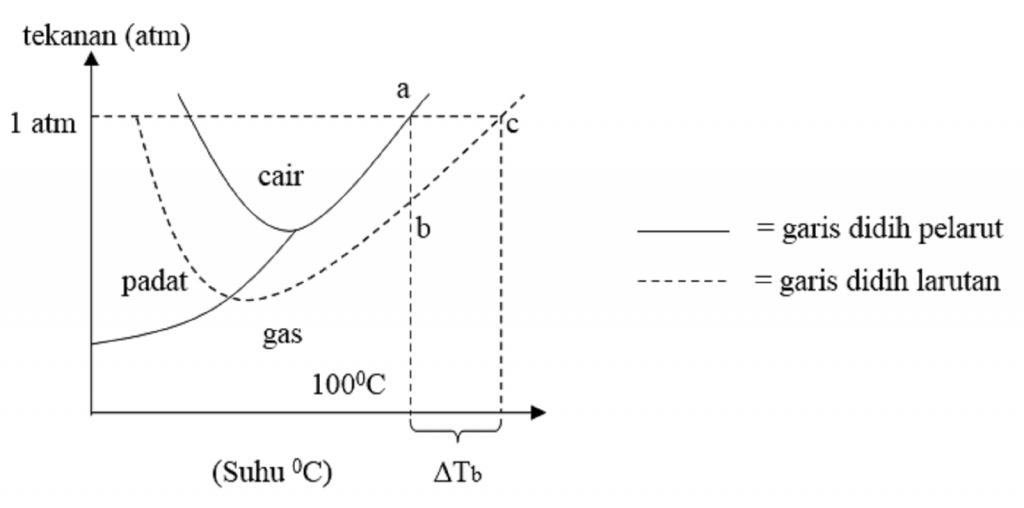
Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆T b ). Rumus untuk menentukan kenaikan titik didih ( ∆T b ) adalah: Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi: T b = K b . m [ 1 + ( n - 1 ) α ]

Tetapan kenaikan titik didih molal (Kb) tergantung pada.
Kenaikan titik didih disebabkan oleh fakta bahwa tekanan uap pelarut dalam larutan yang mengandung zat terlarut lebih rendah daripada tekanan uap pelarut murni (tanpa zat terlarut). Oleh karena itu, agar tekanan uap pelarut mencapai tekanan atmosfer, suhu yang lebih tinggi diperlukan, yang kemudian menghasilkan kenaikan titik didih.
Cara Menentukan atau Menghitung Kenaikan Titik Didih Larutan SERBA SERBI
Kenaikan titik didih merupakan sifat koligatif larutan non elektrolit. Zat terlarut dalam larutan menghalangi gerakan molekul-molekul pelarut sehingga sehingga sukar lepas dari fase cair menjadi gas. Kenaikan titik didih bergantung pada kemolalan larutan. Makin tinggi kemolalan, zat terlarut makin banyak sehingga titik didih makin tinggi.

Sifat Koligatif Larutan Part 1 Penurunan Tekanan Uap dan Kenaikan Titik Didih YouTube
Kenaikan titik didih hanya bergantung pada jenis pelarut dan molaritas larutan, bukan pada jenis zat terlarut.. Tentukan kenaikan titik didih larutan gula 0,2 molal jika K B air = 0,52 °C molal-1. Diskusi. 0,2 larutan gula molal: ΔT B = K B. M = 0,52 °C molal-1 x 0,2 mol = 0,104 °C.

Kumpulan Contoh Soal Kenaikan Titik Didih Kimia Kelas 12 CoLearn halaman 16
Kb = kenaikan titik didih molal (oC/m) yang bergantung pada pelarut Kb adalah konstanta kenaikan titik didih molal dan m adalah molalitas larutan. Satuan Kb. A-B-E. Jadi titik beku air tidak bergantung pada tekanan disekitarnya, melainkan bergantung pada tekanan uap padatnya. Pada diagram fasa (P-T), gambar 1.4

Melihat Proses Kenaikan Titik Didih Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun! Blog
Tb = 100 + 0,6656 = 100,6656 °C. Contoh soal 6 (UN 2019) Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut. Contoh soal 6. Jika Mr NaCl = 58,5 dan Mr glukosa = 180 dan Tb air = 100 C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah…. A. 0,52 °C/m.