Unsur 8a Terletak Dalam Satu Golongan Dengan Unsur D Berbagai Unsur
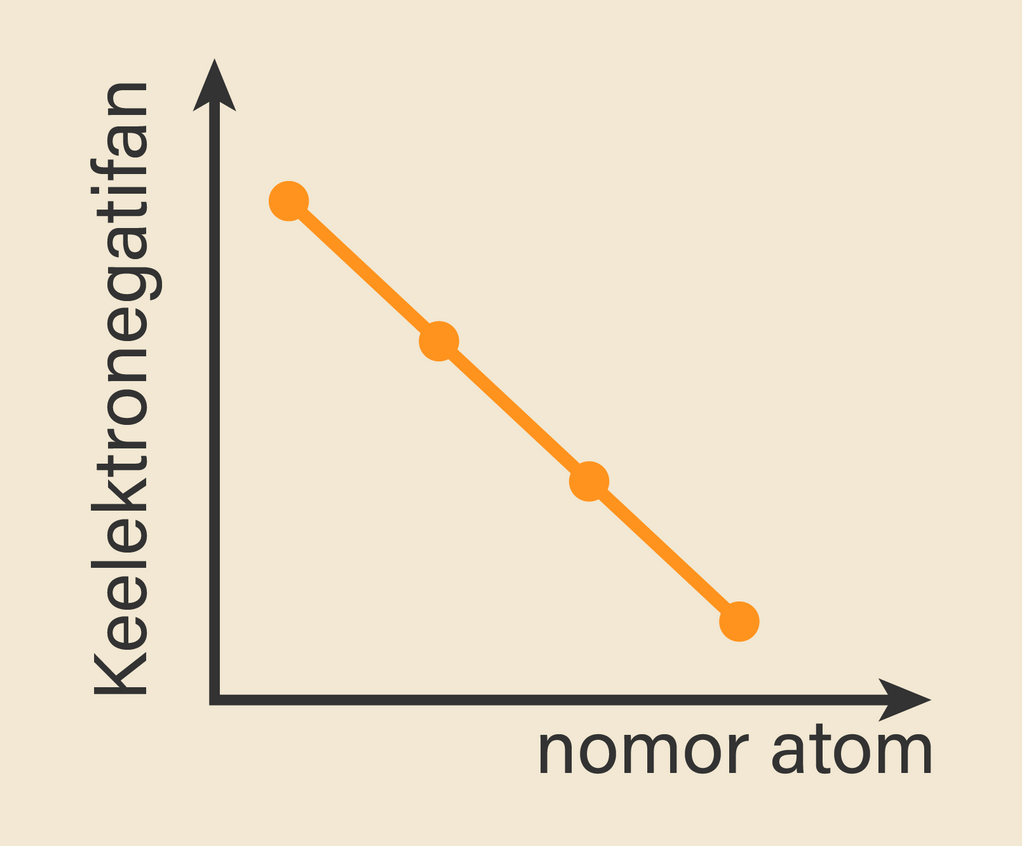
Jadi, keelektronegatifan bertambah apabila kita maju dari bawah ke atas dalam golongan tertentu dari susunan berkala,karena elektron valensi lebih dekat ke inti. Untuk mengamati keelektronegatifan suatu unsur, kalian dapat melihat skala pauling yang dapat menunjukkan tingkat keelektronegatifan suatu unsur.

PPT SIFATSIFAT PERIODIK UNSUR Jarijari atom Energi Ionisasi Afinitas elektron
keelektronegatifan dalam satu golongan Unsur golongan satu dan dua memiliki keelektronegatifan yang lebih kecil; dengan demikian, mereka.

Data harga keelektronegatifan unsurunsur dalam satu peri...
Dalam satu golongan Elektronegatifitas memiliki kecenderungan dari atas ke bawah semakin KECIL sedangkan dalam satu periode dari kiri ke kanan semakin BESAR. Pada soal, terdapat 5 unsur yaitu , , , , dan .: golongan VA periode 3: golongan IIIA periode 3: golongan VIIA periode 4: golongan IA periode 3: golongan VIIA periode 3

latihan soal UN keelektronegatifan dalam Satu golongan kimia SMA YouTube
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen. Konsep elektronegativitas pertama kali oleh Linus Pauling pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi.
Mengapa Cl Mempunyai Bermacammacam Bilangan Oksidasi? Urip dot Info
Pengertian Sifat Keperiodikan Unsur. Sifat Keperiodikan Unsur adalah sifat-sifat unsur yang berubah secara beraturan sesuai dengan kenaikan nomor atom unsur dari atas ke bawah pada suatu golongan atau dari kiri ke kanan dalam satu periode. Nah Sifat Keperiodikan Unsur ini meliputi pengaruhnya terhadap Jari-Jari Atom, Energi Ionisasi, Afinitas.

Sistem Periodik Unsur Sifat Sifat Pada Tabel Periodik Unsur Kimia Hot Sexiz Pix
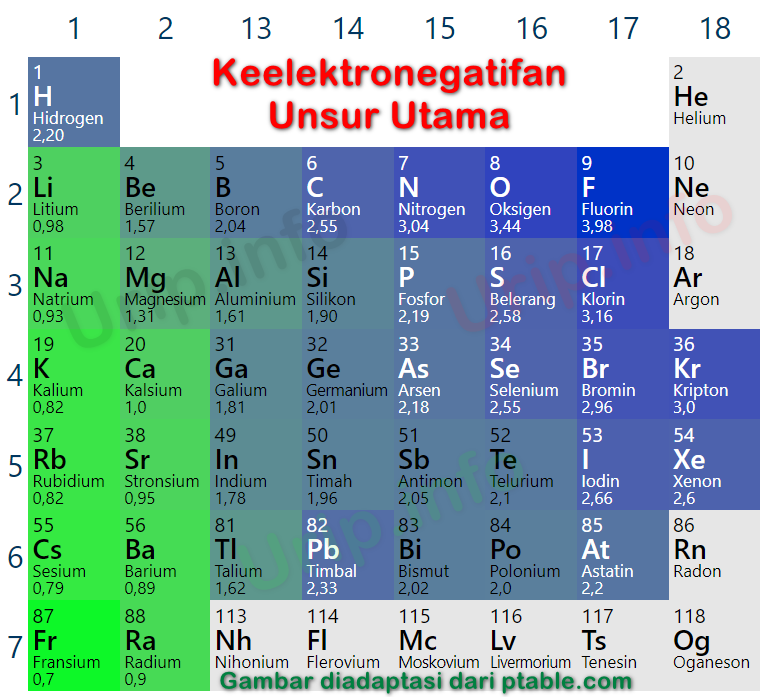
7). Golongan VIIA : F(4,0), Cl(3,0), Br(2,8), I(2,5), At(2,1). Pada ilustrasi di atas ditunjukkan bagaimana kecenderungan sifat keelektronegatifan unsur-unsur golongan utama (IA - VIIA). Golongan VIIIA tidak dimasukkan dalam daftar karena golongan gas mulia umumnya berupa gas yang sangat stabil sehingga tidak reaktif.

Keelektronegatifan unsur golongan VIA dalam skala Pauling...
Keelektronegatifan merupakan kecenderungan atau ukuran kemampuan suatu unsur untuk menarik elektron dan dalam membentuk ikatan ikatan. Dalam satu golongan dari atas ke bawah, keelektronegatifan semakin kecil karena jari-jari semakin panjang sehingga daya tarik inti terhadap elektron semakin lemah.

PPT Perkembangan Model Atom PowerPoint Presentation, free download ID398871
Dalam satu golongan, dari atas ke bawah jumlah kulit bertambah sehingga jarak elektron valensi ke inti atom bertambah dan elektron lebih mudah lepas. Akibatnya, energi ionisasi dalam satu golongan. Dalam satu golongan, keelektronegatifan meningkat dari bawah ke atas. Adapun dalam satu periode, keelektronegatifan meningkat dari kiri ke kanan..

Tabel Periodik Unsur Kimia Lengkap
Keelektronegatifan Pauling, tanpa diragukan lagi, adalah skala yang paling luas dan digunakan, terutama dalam kursus kimia dasar atau kimia umum. Pada skala ini, nilai sewenang-wenang 4,0 ditetapkan untuk keelektronegatifan unsur paling elektronegatif dalam tabel periodik, fluor, dan nilai lainnya ditetapkan berdasarkan nilai referensi tersebut.
Sifat Periodik Unsur
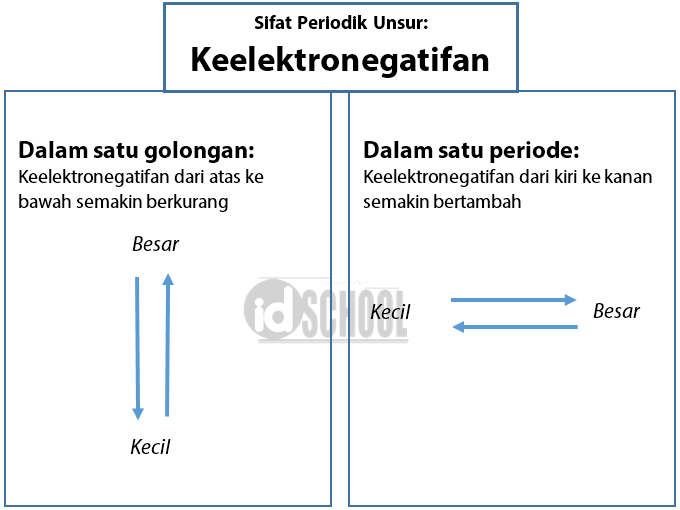
Dalam satu golongan dari atas ke bawah, keelektronegatifan semakin berkurang. Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah. Konsep elektronegativitas pertama kali diperkenalkan oleh Linus Pauling pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi. Elektronegativitas tidak bisa dihitung secara.

Bagaimana Kecenderungan Afinitas Elektron Unsur Dalam Sistem Periodik sisi tegak pada bangun
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika atomatom tersebut membentuk ikatan. Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 sampai 4. Yang mana, unsur yang mempunyai harga keelektronegatifan besar, cenderung menerima elektron dan akan membentuk ion negatif.
Berikut tabel data unsur dan nomor atomnya.
Adapun Unsur fransium yang memiliki keelektronegatifan terendah yaitu 0,7 berada di kiri paling bawah dalam tabel periodik. Kesimpulannya : Dalam satu periode dengan bertambahnya nomor atom, keelektronegatifan cenderung makin besar, dan dalam satu golongan dengan bertambahnya nomor atom, keelektronegatifan cenderung makin kecil.

Keelektronegatifan unsur dalam satu periodekimia sma YouTube
Keelektronegatifan adalah sifat atom yang meningkat dengan kecenderungannya untuk menarik elektron ikatan. Jika dua atom terikat mempunyai nilai keelektronegatifan yang sama antara satu sama lain, mereka berkongsi elektron secara sama rata dalam ikatan kovalen. Biasanya, elektron dalam ikatan kimia lebih tertarik kepada satu atom (yang lebih.

Tabel periodik unsur terdiri dari unsurunsur kimia yang telah ditemukan atau dibuat; mereka
Sama halnya dengan jari-jari atom, sifat keperiodikan unsur yang satu ini juga memiliki kecenderungan sebagai berikut: Dalam satu golongan dari atas ke bawah, energi ionisasi suatu unsur semakin kecil dikarenakan jari-jari atom bertambah besar, sehingga daya tarik inti terhadap elektron terluar semakin lemah dan energi ionisasi berkurang.

Jari Jari Atom Unsur Dalam Satu Periode Dari Kiri Ke Kanan Semakin Kecil Karena Berbagai Unsur
Dalam satu periode keelektronegatifan bertambah dari kiri ke kanan, sedangkan dalam satu golongan keelektronegatifan bertambah dari bawah ke atas. Post Views: 828. Tags: afinitas elektron energi ionisasi jari-jari atom keelektronegatifan Kimia Kelas X sifat keperiodikan unsur. Share 13 Send.

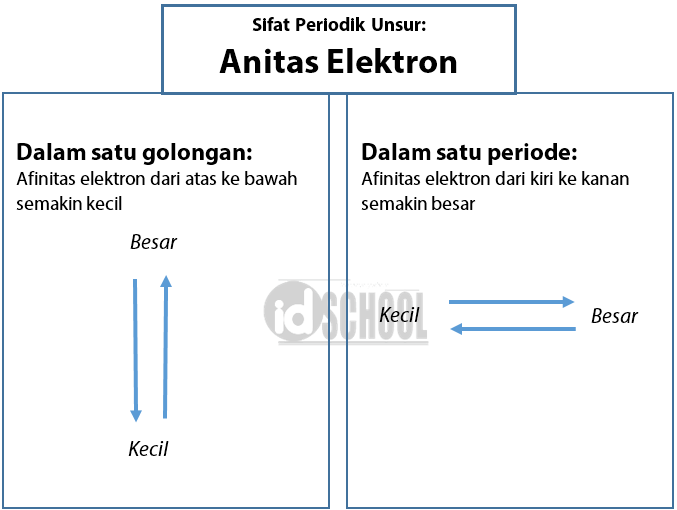
Sifat Keperiodikan Unsur ( Part 2) Afinitas Elektron, Keelektronegatifan dan Sifat Logam
Dalam satu golongan, dari atas ke bawah maka keelektronegatifannya cenderung semakin berkurang. Dalam suatu periode, dari kiri ke kanan maka keelektronegatifannya cenderung semakin bertambah. Ilustrasi logam (Dok PxHere.com) Sifat kelogaman suatu unsur tergantung pada besarnya energi ionisasi, dan afinitas elektron.