
Penurunan Titik Beku
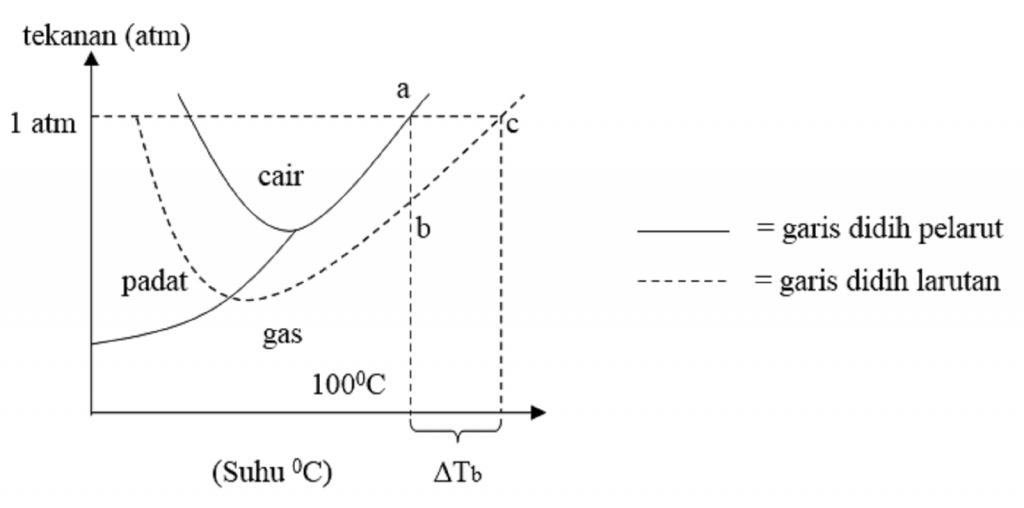
Larutan mendidih pada tekanan 1 atm. Dari gambar di atas dapat dilihat bahwa titik didih larutan (titik G) lebih tinggi daripada titik didih air (titik D).. 5.2 Tabel Penurunan Titik Beku a) Tuliskan tujuan praktikum hari ini Jawab : Mengetahui titik beku pada larutan Mengetahui penurunan titik beku pada larutan b) Isilah tabel data.

Mengetahui Proses Penurunan Titik Beku Kimia Kelas 12
Contoh Soal Penurunan Titik Beku - Membahas mengenai perhitungan suatu proses kimia terkait zat berbentuk larutan. Dimana reaksi penurunan titik beku tersebut terjadi pada saat suatu larutan saat ditambahkan senyawa lain. Jika dilihat dari sudut pandang ilmu kimia, larutan mempunyai berbagai sifat baik dalam bentuk sifat kimia ataupun sifat fisis.. Dimana salah satu materi sifat fisis.

Praktikum kimia penurunan titik beku XII YouTube
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.

SIFAT KOLIGATIF LARUTAN PENURUNAN TITIK BEKU YouTube
Contoh Titik Beku dalam Kehidupan Sehari-hari Pembekuan adalah fenomena transisi fase, di mana keadaan cair dari zat tertentu diubah menjadi keadaan padat. Ini juga dikenal sebagai "solidifikasi". Contoh pembekuan yang paling umum, yang diamati setiap hari, adalah pembentukan es batu di baki es ketika air disimpan di dalam freezer untuk beberapa waktu.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
4. Penambahan etilena glikol pada radiator mobil (titik beku) 15. Suatu larutan urea dalam air memiliki penurunan titik beku 0,372 °C. Jika Kb air = 0,52 °C/m dan Kf air = 1,86 °C/m maka kenaikan titik didih larutan urea tersebut adalah.. Jawaban: Hitung dulu molal zat dari data penurunan titik beku ∆Tf = m x Kf 0,372= m x 1,86 m = 0.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Contohnya termasuk penambahan garam dalam air, alkohol dalam air, atau pencampuran dua padatan seperti pengotor menjadi obat bubuk halus. Dalam kasus terakhir, senyawa yang ditambahkan adalah zat terlarut, dan padatan asli dianggap.
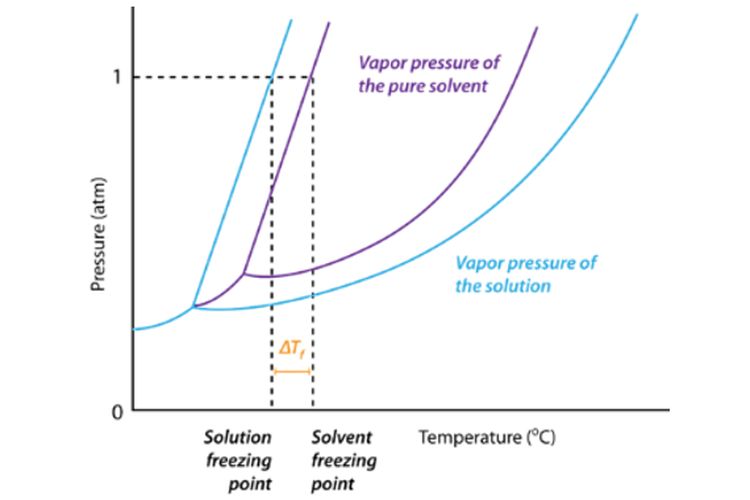
Foto Sifat Koligatif Penurunan Titik Beku
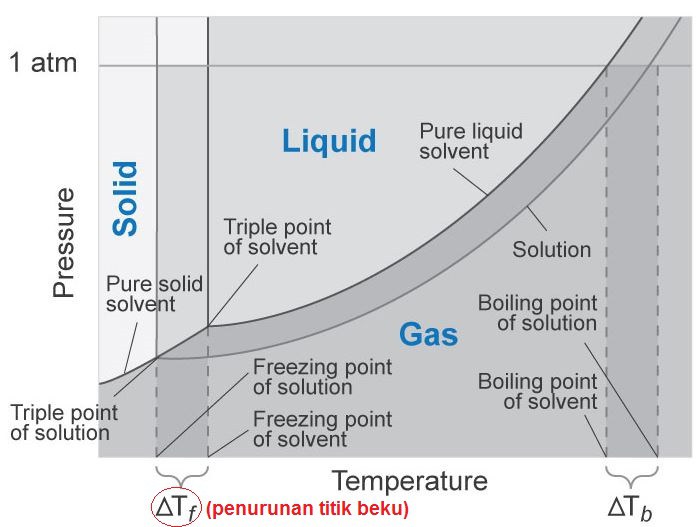
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Penerapan Sifat Koligatif Penurunan Titik Beku
Titik beku asam asetat murni ditentukan dari temperatur yang konstan. Pada gambar 1 ditunjukkan pada menit 9, 10, dan 11, temperatur asam asetat konstan sebesar 15°C. Berdasarkan referensi yang didapatkan titik beku asam asetat adalah 16,7°C. Hasil yang kami dapatkan berbeda, hal ini dikarenakan beberapa faktor.

penurunan titik beku (soal 9) sifat koligatif kimia kelas 12 YouTube
Penurunan titik beku adalah fenomena fisika di mana titik beku suatu zat cair, seperti air, menurun ketika zat tersebut dicampur dengan zat lain (biasanya dalam bentuk larutan atau campuran). Fenomena ini terjadi karena adanya interaksi antara zat-zat dalam larutan yang mengganggu tata letak molekul atau partikel dalam fase padat, sehingga.

Penurunan Titik Beku
Persamaan Penurunan Titik beku. Penurunan titik beku dapat dihitung menggunakan persamaan Clausius-Clapeyron dan hukum Raoult. Dalam larutan ideal encer titik beku adalah: Titik beku larutan total = Titik beku larutan - ΔTf. dimana ΔTf = molalitas * Kf * i. K f = konstanta titik beku air (1,86 ° C kg / mol ) i = Faktor Van't Hoff.
PENURUNAN TITIK BEKU LARUTAN DAN APLIKASINYA
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Penurunan Titik beku YouTube
Besar penurunan titik beku didapat dari selisih antara titik beku pelarut dan titik beku larutan sebagai berikut: Dengan, ΔTf: penurunan titik beku Tf0: titik beku pelarut murni Tf: titik beku larutan. Baca juga: Sifat Koligatif Larutan Elektrolit dan Faktor Vant Hoff . Dilansir dari Chemistry LibreTexts, penurunan titik beku bergantung pada.
Penurunan Titik Beku Larutan Tergantung Pada Reverasite
Pelajari Juga: 10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih dan Penurunan Titik Beku PDF. Dari gambar diagram PT diatas dapat dilihat bahwa titik didih larutan (G) lebih tinggi daripada titik didih air (D). Sedangkan titik beku larutan (F) lebih rendah daripada titik beku air (E).

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".

Penurunan Titik Beku XII IPA 4 SMAN 1 CIKANDE YouTube
6 Jurnal sains kimia Vol.II No.2,200 Gambar 2. Grafik penurunan titik beku naftalena Tabel 7. Penurunan Titik Beku Asam Asetat Murni pada Temperatur Ruang 29 C untuk zat terlarut Natrium Asetat 2 3 4, , , , ,055 Suhu ( C) 22 7,5 3 3 Tabel 8. Penurunan Titik Beku Zat Terlarut Natrium Asetat pada Larutan B Suhu ( C) , Titik Beku larutan B = 3 C.

Penurunan Titik Beku Contoh Soal [Pembahasan Simpel] YouTube
Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan. Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram. Mr = 60.