
Larutan etanol (Mr etanol = 46) memiliki fraksi mol zat t...
Np = jumlah mol zat pelarut. Jumlah fraksi mol zat terlarut dan zat pelarut yaitu 1. Xt + Xp = 1. Contoh Fraksi Mol. Misalkan pada sebuah larutan yang terbuat dari 5,85 gram garam dapur ( Mr = 58,5 ) yang di larutkan ke dalam 120 gram air ( Mr = 18 ). Maka suatu fraksi mol garam dapur dan fraksi mol air tersebut dapat dihitung dengan cara berikut :

Contoh Soal Fraksi Mol
Jumlah fraksi mol zat terlarut dan pelarut adalah 1: X A + X B = 1. atau secara umum fraksi mol dapat dapat dirumuskan sebagai berikut: X = (mol zat pelarut / mol pelarut) = n 1 / (n 1 + n 2) Fraksi Mol Zat Terlarut (Xt) Fraksi mol zat terlarut (Xt) yang dirumuskan dengan rumus seperti berikut ini: Xt = (nt / nt + np) Fraksi Mol Zat Pelarut (Xp)

Kumpulan Contoh Soal Fraksi Mol dan Pembahasannya Terbaru 2022 Portal Kudus Halaman 2
KOMPAS.com - Dilansir dari Encyclopedia Britannica (1999), Fraksi mol merupakan salah satu satuan konsentrasi larutan selain molalitas dan juga molaritas. Fraksi mol adalah perbandingan jumlah mol suatu zat (nt) dalam larutan dengan jumlah mol seluruh zat (np) dalam larutan. Fraksi mol dirumuskan sebagai berikut: persamaan fraksi mol terlarut.

Contoh Soal Dan Pembahasan Fraksi Mol Soal Kelasmu
Xp = Fraksi mol pelarut Xt = Fraksi mol terlarut P° = Tekanan uap jenuh dari zat pelarut murni (mmHg) P = Tekanan uap larutan (mmHg) Contoh Soal Penurunan Tekanan Uap dan Penyelesaian Tentukan tekanan uap jenuh air pada larutan yang mengandung 12 % massa urea CO(NH 2) 2, jika diketahui Mr = 60 gram/mol. Penyelesaian: Kenaikan titik didih (∆Tb)

KIMIA KELAS XII Fraksi Mol Pelarut & Fraksi Mol terlarut. YouTube
Simbol dari fraksi mol ini adalah huruf X kapital. Rumus dari fraksi mol adalah sebagai berikut. Keterangan: X t = fraksi mol zat terlarut. X p = fraksi mol zat pelarut. n t = mol zat terlarut. n p = mol zat pelarut. Kadar Zat Terlarut (%) Untuk kadar zat terlarut, kita bisa dibedakan lagi menjadi dua, yaitu kadar massa dan kadar volume.

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Konsentrasi Larutan: Pengantar, Persen Massa, Molaritas, Molalitas, Fraksi Mol [Lengkap+Contoh Soal] Ditulis oleh Husnul Khatimah • 17 Februari 2024. Banyaknya zat terlarut dalam larutan dinyatakan dengan konsentrasi larutan yang terdiri dari persen massa, molaritas, molalitas, dan fraksi mol. Pada artikel ini akan membahas materi konsentrasi.

Kumpulan Soal Fraksi Mol Terlarut Dan Pelarut Lengkap Dengan Pembahasan Riset
1. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat pelarut dalam larutan tersebut adalah…. a. 0,4 mol. b. 0,5 mol. c. 0,6 mol. d. 0,8 mol. e. 1,0 mol. Jawaban: Diketahui: X t.

Kumpulan Contoh Soal Fraksi Mol dan Pembahasannya Terbaru 2022 Halaman 4
Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas Dalam larutan, terdapat beberapa sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut. Oleh karena sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut, maka perlu diketahui tentang konsentrasi larutan. Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat.

Contoh Soal Fraksi Mol Dan Pembahasannya
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.

2 Contoh Soal Fraksi Mol Terlarut 2 Contoh Soal Fraksi Mol Terlarut Rumus fraksi mol zat
Dalam ilmu kimia, fraksi mol menunjukkan perbandingan mol suatu zat dengan mol total semua zat dalam larutan. Fraksi mol terbagi menjadi dua macam, yaitu fraksi mol zat terlarut (Xt) dan fraksi mol zat pelarut (Xp). Dikutip dari Sifat Koligatif Larutan oleh Haqqi Annazili Nasution, dkk. (2022: 3.
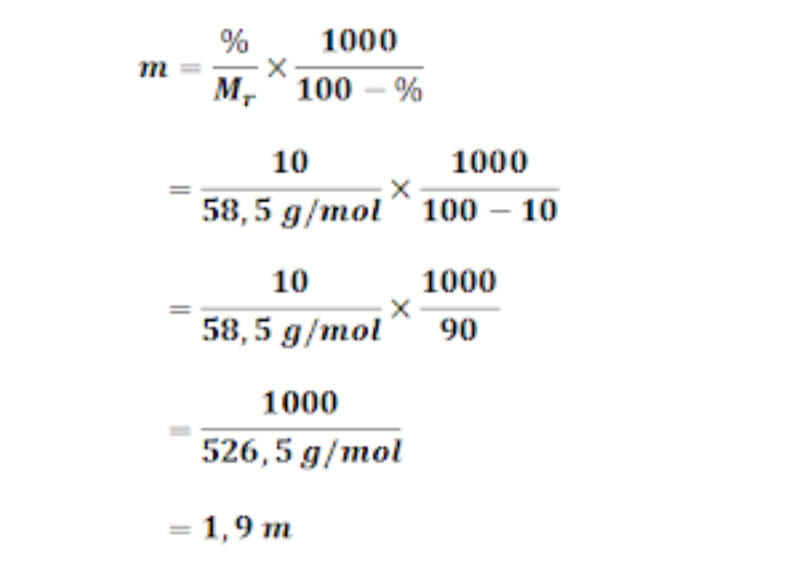
Cara Menghitung dan Contoh Soal Fraksi Mol dan Jawabannya Rumus dan Pembahasan Fraksi Mol
Pengertian Fraksi Mol. Dikutip dari buku 'Cerdas Belajar Kimia' terbitan Grafindo, fraksi mol adalah pernyataan konsentrasi suatu larutan yang menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol total komponen larutan (jumlah mol pelarut + jumlah mol zat terlarut).

Cara Menentukan Massa Jenis Zat
Jika larutan diuapkan sebagian, maka mol fraksi dari masing-masing penyusun larutan tidak sama karena volatilitas (mudahnya menguap). hubungan antara jumlah zat terlarut dengan tekanan uapnya merupakan fungsi linier (semakin banyak solute, maka tekanan uap akan semakin kecil), sedangkan pada larutan yang tidak encer,.

Menghitung Fraksi Mol Kelas 12 Soal & Pembahasan [Dilengkapi Konsep Mudah] YouTube
Dilansir dari Chemistry LibreTexts, fraksi mol adalah perbandingan mol suatu zat dalam suatu campuran dengan jumlah mol semua zat. Seperti yang kita ketahui, campuran atau larutan pada umumnya terdiri dari dua komponen yaitu zat terlarut dan zat pelarut. Sehingga, ada yang dinamakan fraksi mol zat terlarut dan fraksi mol zat pelarut. Fraksi mol.

Larutan asam klorida 18,25 mempunyai massa jenis 1,1 g/mL. Tentukan fraksi mol masingmasing
X t = fraksi mol zat terlarut; X p = fraksi mol pelarut; n t = mol zat terlarut; dan. n p = mol zat pelarut. 8. Pengenceran. Untuk mengurangi tingkat kepekatan suatu larutan, Quipperian bisa melakukannya dengan menambahkan air. Metode ini dikenal sebagai pengenceran. Larutan yang diencerkan jelas mengalami perubahan konsentrasi dan volume.

Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol YouTube
Nt : Jumlah mol zat terlarut; Fraksi mol zat palarut (Xp) biasa dirumuskan dengan rumus seperti berikut ini: rumus fraksi mol zat pelarut.. Hubungan antara Molalitas dengan Persen massa. Persen massa ialah satuan konsentrasi yang juga dapat digunakan didalam larutan kimia. Contohnya ialah larutan yang biasa kita jumpai sehari-hari yaitu larutan.
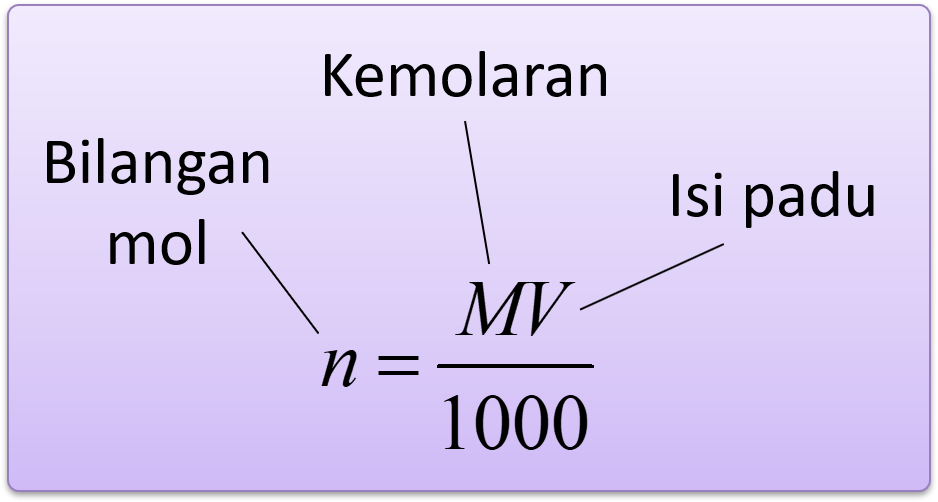
Menghitung Amaun Zat Terlarut Kimia SPM
Molaritas (M) ailah banyaknya mol zat terlarut dalam 1 liter larutan, sedangkan Molalitas (m) ialah banyaknya mol zat terlarut dalam 1kg pelarut. Moralitas ( M ) yaitu satuan konsentrasi yang banyak dipakai dan didefinisikan sebagai banyak mol zat terlarut dalam 1 liter larutan dalam satuan M. Sedangkan