
Grafik Energi Ionisasi bintangutama69.github.io
Dalam satu periode, semakin ke kanan, energi ionisasi akan semakin besar. Sementara itu, dalam satu golongan, semakin ke bawah energi ionisasi semakin kecil. Namun, ketentuan tersebut tidak berlaku untuk unsur periode 3 seperti Mg, Al, P, dan S. 3. Afinitas elektron. Afinitas elektron adalah energi yang dilepaskan oleh atom gas untuk berubah.

Jari Jari Atom Unsur Dalam Satu Periode Dari Kiri Ke Kanan Semakin Kecil Karena Berbagai Unsur
Dalam berilium, elektron pertama berasal dari orbital 2s, yang dapat menampung dua elektron yang stabil dengan satu elektron. Dalam boron, elektron pertama dikeluarkan dari orbital 2p, yang stabil ketika memegang tiga atau enam elektron.. Nilai energi ionisasi tertinggi dalam suatu periode adalah gas mulianya. Istilah Terkait Energi Ionisasi.

Apa yang dimaksud dengan energi ionisasi Bisquick
Dalam SI, satuan energi ionisasi ialah elektron volt (eV), atau kilojoule per moule (kJ/mol). Contoh Energi Ionisasi. Unsur-unsur dalam satu tabel periode memiliki kecenderungan berupa nomor muatan suatu unsur bertambah terus-menerus sebesar 0.65 di setiap elektron yang ditambahkan.

Energi ionisasi kelima unsur yang terletak pada periode k...
Energi ionisasi (Ei) adalah energi yang diperlukan untuk mengeluarkan elektron dari tiap mol spesies dalam keadaan gas. Ei adalah sifat periodisitas.. Untuk unsur-unsur dalam satu periode dalam tabel periodik unsur, dengan naiknya nomor muatan inti efektif semakin membesar secara kontinu, yaitu naik kira-kira sebesar 0,65 satuan untuk setiap.

Pengertian Energi Ionisasi Unsur Kimia, Nomor Atom, Satu Golongan, Periode
Kecenderungan energi ionisasi dalam periode. Untuk unsur-unsur dalam satu periode dalam tabel periodik unsur, dengan naiknya nomor muatan inti efektif semakin membesar secara kontinu, yaitu naik kira-kira sebesar 0,65 satuan untuk setiap tambahan satu elektron, yang berakibat jari-jari atom semakin mengecil.

PPT PERKEMBANGAN SISTEM PERIODIK UNSUR PowerPoint Presentation ID903267
Jika nomor atom dalam satu golongan makin kecil, maka yang bertambah besar adalah energi ionisasi, afinitas elektron, dan kelektronegatifannya. Halaman all. Adapun, dalam periode jari-jari atom makin kecil dari kiri ke kanan. Hal tersebut dikarenakan muatan inti atom yang makin banyak, tetapi jumlah kulit elektron tetap..

Pembahasan Soal Energi Ionisasi Periode Ketiga YouTube
Secara periodik, dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah. Energi ionisasi bergantung pada elektron yang akan dilepaskan, yakni besar gaya tarik inti terhadap elektron kulit terluar. 3. Afinitas Elektron. Besarnya energi yang dihasilkan.

Foto Sifat Periodik Unsur Halaman 1
Tampak bahwa dalam satu periode, dari kiri ke kanan energi ionisasi (EI) cenderung meningkat diakibatkan semakin kuatnya muatan inti efektif menyebabkan elektron terluar semakin sulit dilepas. Sementara itu dalam 1 golongan dari atas ke bawah EI cenderung menurun akibat jarak elektron terluar ke inti atom yang semakin menjauh. 3. Afinitas Elektron

Perhatikan grafik hubungan antara energi ionisasi dengan
2. Energi Ionisasi Energi ionisasi adalah energi yang diperlukan untuk melepaskan satu elektron terluar dari suatu atom atau ion dalam fase gas. Contoh: Kalsium mempunyai energi ionisasi pertama, IE1 adalah 590 kJ / mol, sebagai berikut: Ca (g) + 590 kJ → Ca+(g) + e-
Energi Ionisasi MateriKimia
Kecenderungan Energi Ionisasi Pada Periode. Pada unsur-unsur kimia yang ada pada satu periode dalam tabel periodik unsur, dengan naiknya suatu nomor muatan inti efektif maka akan semakin besar dengan cara yang kontinu, kenaikkan nya di perkirakan sebesar 0,65 dalam satuan pada setiap tambahan suatu elektron, hal tersebut mengakibatkan jari-jari pada suatu atom akan semakin pendek.

Unsur yang memiliki energi ionisasi seperti dalam tabel b...
1. Terdapat unsur-unsur AA, AB, AC, AD, AE yang berada pada satu golongan unsur. Diketahui besar energi potensial ionisasi sebesar 56 kJ/mol, 183 kJ/mol, 118 kJ/mol, 254 kJ/mol, dan 63 kJ/mol secara berturut-turut. Tentukan urutan yang sesuai dengan kenaikan nomor atom dari unsur-unsur tersebut!

PPT SIFATSIFAT PERIODIK UNSUR Jarijari atom Energi Ionisasi Afinitas elektron
Energi ionisasi menunjukkan periodisitas pada tabel periodik. Kecenderungan umum adalah energi ionisasi meningkat bergerak dari kiri ke kanan melintasi periode unsur. Bergerak dari kiri ke kanan melintasi satu periode, jari-jari atom berkurang, sehingga elektron lebih tertarik ke inti (yang lebih dekat).

SifatSifat Keperiodikan Unsur Energi Ionisasi Secara Golongan & Periode YouTube
Energi ionisasi adalah energi yang diperlukan untuk mengionkan satu mol atom dalam keadaan gas. Dalam satu periode pada tabel periodik unsur, energi ionisasi cenderung meningkat sepanjang periode dari kiri ke kanan. Pada dasarnya, energi ionisasi meningkat karena: Jumlah proton (zat inti) meningkat: Saat kita bergerak dari kiri ke kanan dalam satu periode, jumlah proton dalam
Pengertian Energi Ionisasi dalam Tabel Periodik Kimia Garda Pengetahuan
Dalam satu periode, energi ionisasi unsur bertambah dari kiri ke kanan karena jari-jari atom semakin kecil, sehingga daya tarik inti terhadap atom terluar semakin kuat dan energi ionisasi bertambah. Namun, kecenderungan tersebut tidak berlaku pada unsur periode 3 seperti Mg (Magnesium), Al (Aluminium), P (Fosfor), dan S (Sulfur atau Belerang)..

32+ Tabel Periodik Energi Ionisasi Desktop
Dalam satu periode, dari kiri ke kanan, energi ionisasi pertama cenderung semakin besar, sebagaimana pertambahan muatan inti efektif sehingga tarikan oleh inti bertambah. Ringkasan sifat-sifat sistem periodik unsur: jari-jari atom, energi ionisasi, dan sifat logam (Sumber: Petrucci, Ralph H. et al. 2011.

Hubungan antara energi ionisasi unsurunsur periode ketig...
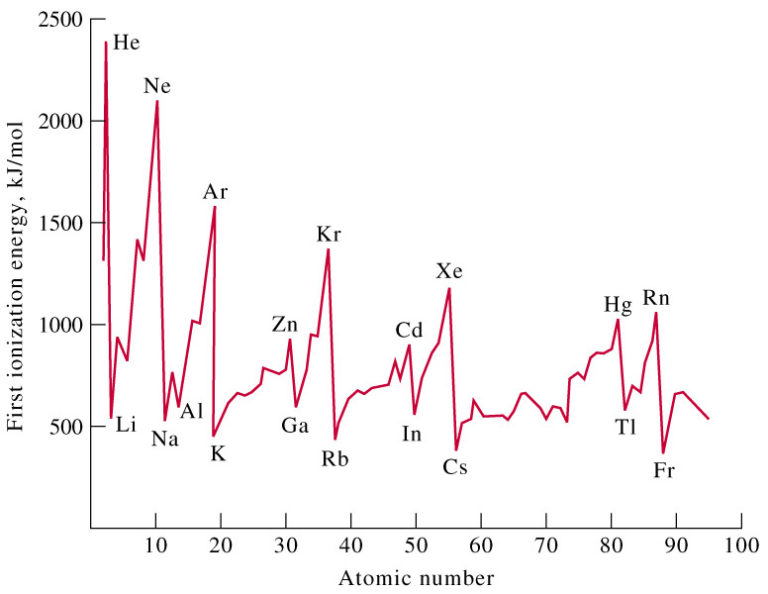
Dengan kata lain, dalam satu periode energi ionisasi meningkat dari kiri ke kanan. Energi ionisasi dalam sistem periodik unsur digambarkan dalam gambar di bawah ini: Afinitas Elektron Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral dalam wujud gas pada waktu menerima satu elektron sehingga terbentuk ion negatif. Jika.