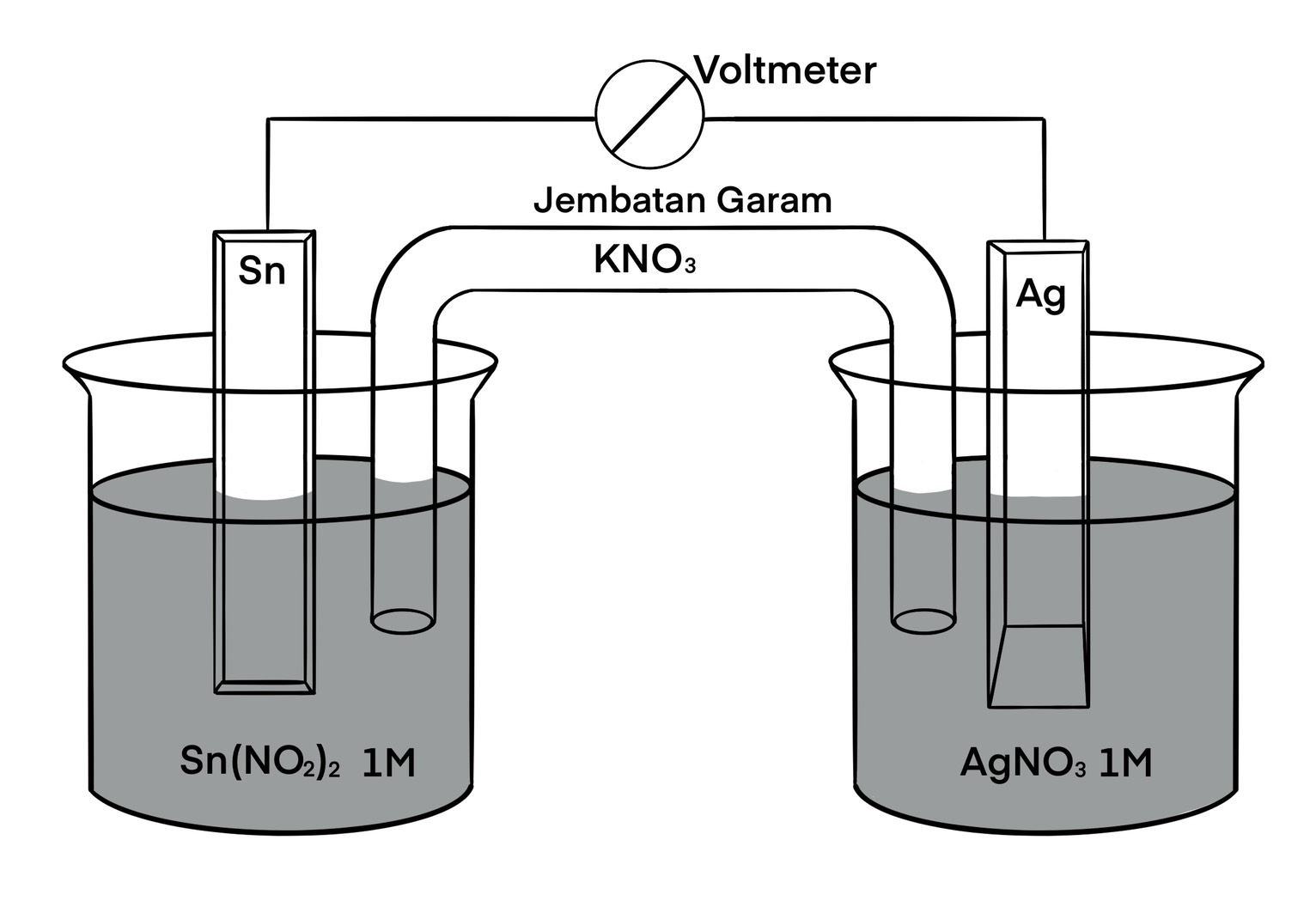
Pembahasan UTBKSBMPTN 2019 Sel Volta
Contoh Soal 4. Tuliskan reaksi sel volta secara lengkap dari notasi sel berikut. Fe∣ Fe 2+ ∣∣ Ag + ∣ Ag. Jawab: Notasi sel biasa ditulis dengan format Anoda ∣∣ Katoda. Fe∣ Fe 2+ ∣∣ Ag + ∣ Ag. Dari notasi tersebut, dapat diketahui bahwa pada anoda, Fe teroksidasi menjadi Fe 2+ dan pada katoda, Ag + tereduksi menjadi Ag.
Kumpulan Contoh Soal Sel Volta Pilihan Ganda Penjelasan Dikdasmen ID
Demikian postingan Sekolahmuonline yang menyajikan soal pilihan ganda Kimia Kelas 12 Bab 4 Sel Volta dan Aplikasinya dalam Kehidupan. Soal kami rujuk dari Modul PJJ Kimia Kelas 12. Semoga bermanfaat. Silahkan baca postingan-postingan Sekolahmuonline lainnya.
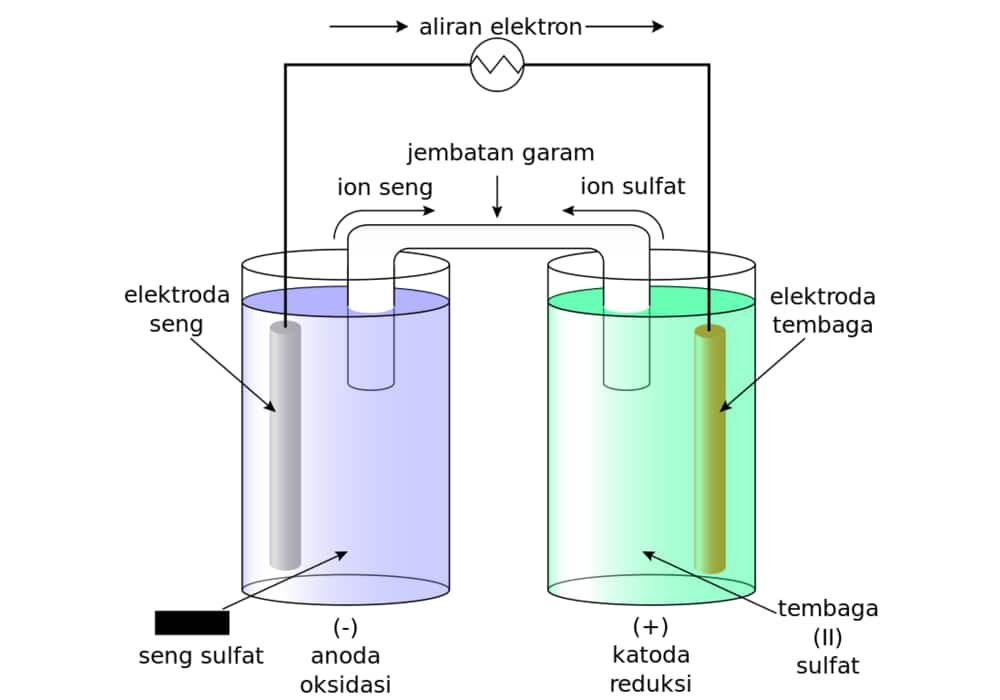
Elektrokimia Sel Galvani / Sel Volta dan Sel Elektrolisis Soal & Jawaban
Download Modul "Sel Volta" untuk Materi yang Lebih Lengkap dan Contoh Soal yang Lebih Banyak Di Sini. Pada gambar di atas, terlihat rangkaian sel volta dengan dua kompartemen. Masing-masing kompartemen merupakan setengah sel. Pada kompartemen kiri, dalam larutan ZnSO 4 terjadi setengah reaksi oksidasi Zn menjadi ion Zn 2+, sedangkan pada kompartemen kanan, dalam larutan CuSO 4 terjadi.

firstwisnu media Sel Volta Si Pengubah Reaksi Kimia Menjadi Energi Listrik, Kece Deh!
Soal nomor 1. Sel volta terdiri dari elektrode perak dan tembaga, jika : Ag + + e → Ag E 0 = +0,80 volt. Cu 2+ + 2e → Cu E 0 = +0,34 volt. Pernyataan di bawah ini yang benar adalah.. A. Ag sebagai Anoda. B. Cu sebagai Katoda. C. potensial selnya = 0,46. D. elektroda Ag semakin tipis.

Notasi sel Voltasoal menggunakan deret voltakimia SMA YouTube
Rangkaian Sel Volta: Kedua larutan dihubungkan oleh jembatan garam yang berisi KCl. Elektron mengalir dari elektroda Zn (sebagai anoda) ke elektroda Cu (sebagai katoda) melalui kawat eksternal. Setengah sel yang satu terdiri dari logam seng (zinc) yang dicelupkan ke dalam larutan dan setengah sel yang lainnya terdiri atas logam tembaga (copper.

Soal Dan Pembahasan Materi Sel Volta Dan Perkaratan Beserta Pembahasannya Materi Soal
Contoh Soal Sel Volta. Berikut ini pernyataan yang benar mengenai sel volta, kecuali…. a. elektron mengalir dari katoda ke anoda. b. katoda bermuatan positif. c. di elektroda negatif terjadi reaksi oksidasi. d. kation di sekitar anoda akan bertambah. e. di katoda terjadi reaksi penangkapan elektron.

Reaksi Redoks dan Elektrokimia Kimia Kelas 12 • Part 8 Contoh Soal Sel Volta YouTube
Contoh soal sel volta nomor 6. Diketahui potensial elektrode standar dari beberapa logam sebagai berikut. Ag + |Ag E 0 = +0,80 V Cu 2+ |Cu E 0 = +0,34 V Pb 2+ |Pb E 0 = -0,13 V Sn 2+ |Sn E 0 = -0,14 V Co 2+ |Co E 0 = -0,28 V Bila kelima elektrode di atas saling dipasangkan untuk membentuk sel volta, maka elektrode yang tidak mungkin dapat sebagai anode adalah.

Perhatikan sel Volta berikut! AlCl3 Al() V Sn(+) SnCl2 D...
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya. Kamu dapat download modul & contoh soal serta kumpulan latihan soal Sel Volta 1 dalam bentuk pdf pada link dibawah ini: Modul Sel Volta 1. Kumpulan Soal Mudah, Sedang & Sukar.

Contoh Soal Tentang Sel Volta
Ilustrasi Contoh Soal Sel Volta. Foto: dok. Vstretimsya Na Rassvete (Unsplash.com) Untuk memudahkan Anda memahami materi sel volta, berikut ini adalah salah satu contoh soal sel volta lengkap dengan jawabannya: Diketahui potensial elektrode perak dan tembaga sebagai berikut. Ag+ + e → Ag Eo = +0.80 V. ADVERTISEMENT.
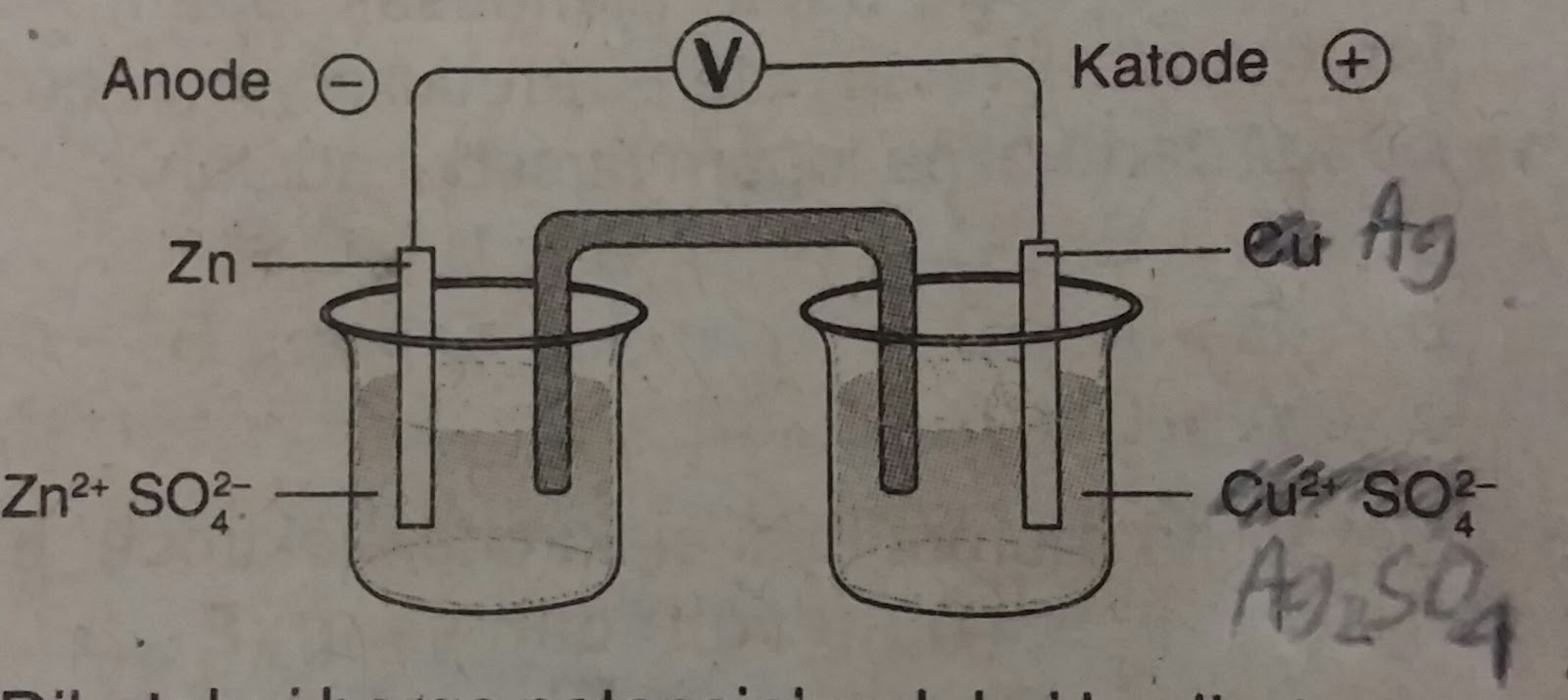
Contoh Soal dan Pembahasan Sel Galvani, Sel Volta Anak Sekolah
Sel Volta: Pengertian, Rumus, Contoh, Soal. Februari 5, 2024 Oleh Yuliantito, S.Si. Contents show Pengertian Sel Volta. Sel volta adalah sel yang dapat mengubah energi kimia menjadi energi listrik melalui mekanisme reaksi oksidasi reduksi (redoks) yang terjadi secara spontan.. Contoh sel volta yaitu sel yang menggunakan logam Zn dan Cu.

Soal Dan Pembahasan Sel Volta
Kumpulan Soal Ulangan Sel Volta & Pembahasannya. Soal No.1. Diketahui data potensial elektrode standar (E o) dari logam A dan logam B sebagai berikut. A 2+ (aq) + 2e - → A (s) E o = +0,30 volt. B 2+ (aq) + 2e - → B (s) E o = -0,40 volt. Jika logam A dan B disusun pada suatu sel volta dengan A dan B sebagai elektrode, maka pernyataan.

Contoh Soal Sel Volta No.2 YouTube
Contoh Soal Materi Sel Volta. Biar kamu makin dalam belajar tentang sel voltanya, coba yuk kerjakan contoh soal dari Quipper Video yang ada di bawah ini. Contoh Soal 1. Pembahasan: Dari soal 1 terlihat bahwa terdapat 5 unsur logam yang memiliki potensial yang berbeda-beda.
Contoh Soal Kimia Sel Volta Soal Kelasmu
Sel volta berfungsi untuk menggambarkan energi yang dilepas reaksi redoks menjadi energi listrik. Berikut soal sel volta kelas 12 dan pembahasan. 1. Tentukan besar potensial sel (E⁰ sel) dari kedua elektrode di atas: a. Diketahui: Cu2+ (aq) + 2 eˉ → Cu (s) E⁰ = + 0,34 V. Zn2+ (aq) + 2 eˉ → Zn (s) E⁰ = - 0,76 V.

Sel Volta Simple konsep & Contoh Soal YouTube
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Sel Volta 2 dalam bentuk pdf pada link dibawah ini: Modul Sel Volta 2; Kumpulan Soal Mudah, Sedang & Sukar; Definisi. Berkaitan dengan konsep lanjutan dari sel volta, termasuk perhitungan yang melibatkan energi bebas Gibbs, sel konsentrasi dan diagram Latimer.
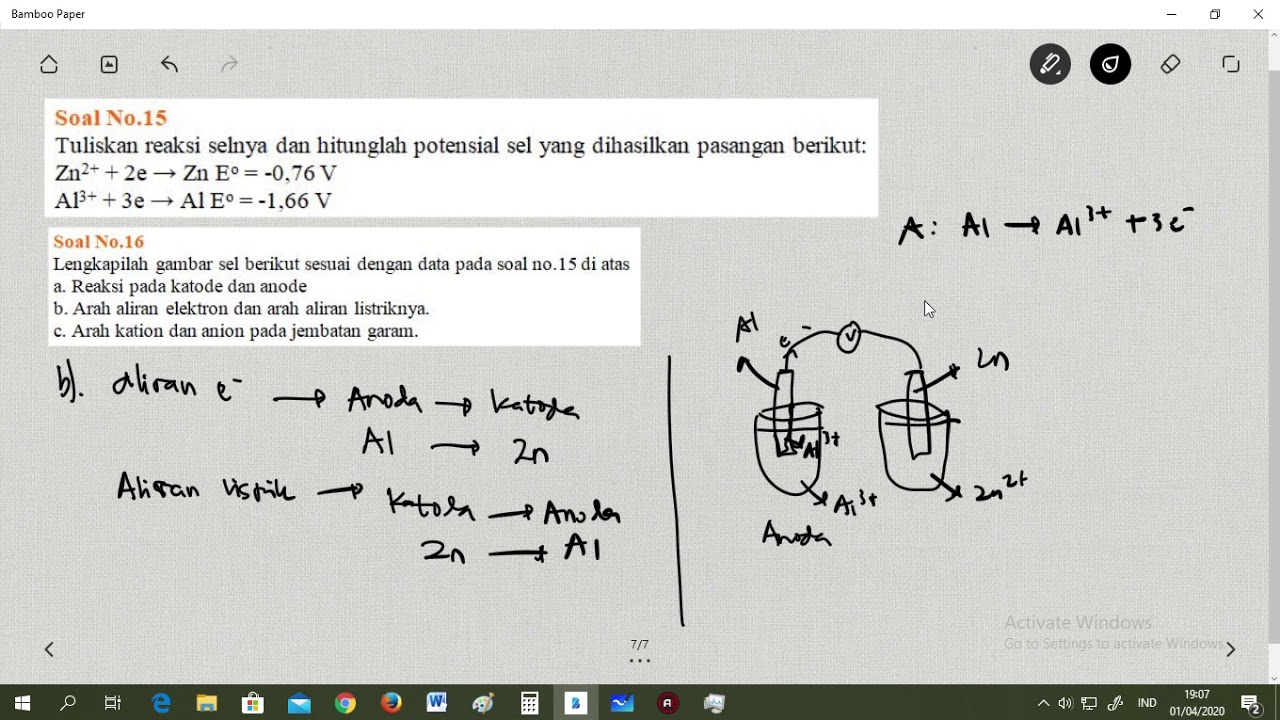
Contoh Soal Sel Volta No.16 YouTube
Contoh soal sel volta kimia kelas 12 SMA MA kurikulum 2013 ini untuk membantu belajar peserta didik dalam memahami materi sel volta. Bentuk latihan soal sel volta kimia kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.
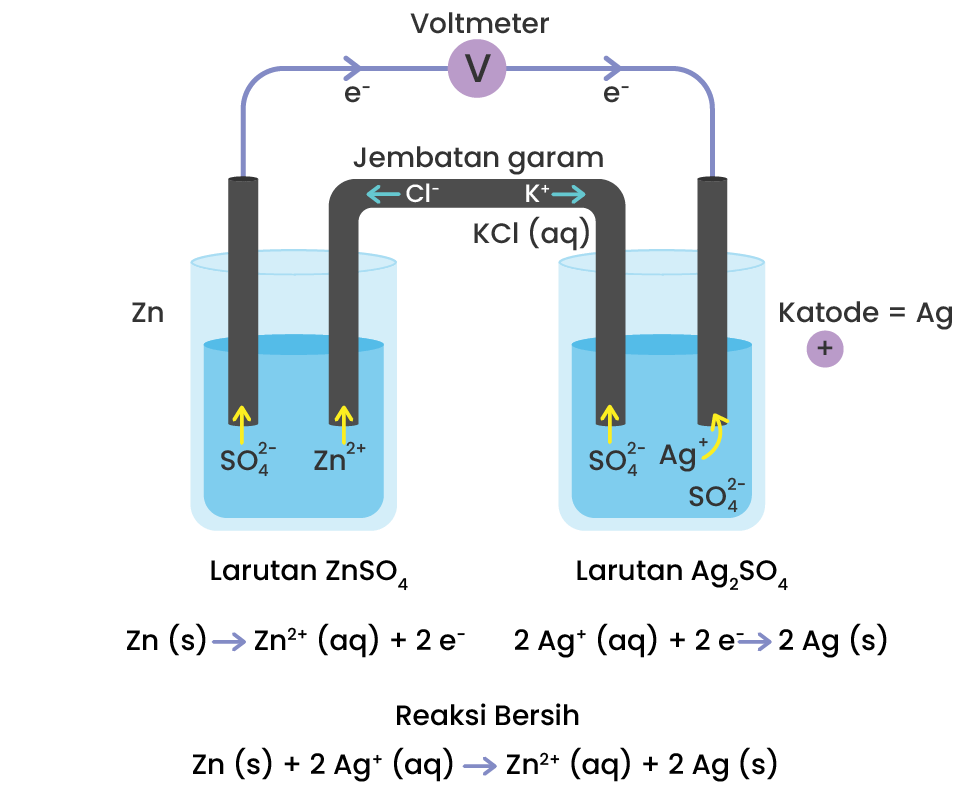
Diagram sel volta berikut digunakan untuk menjawab...
Pembahasan Dalam Bentuk Video: Contoh Soal Sel Volta No.1. Soal No.2. Diketahui potensial elektrode zink, tembaga dan alumunium sebagai berikut. Zn 2+ + 2e → Zn E o = -0,76 V. Cu 2+ + 2e → Cu E o = +0.34 V. Al 3+ + 3e → Al E o = -1,66 V. a. Tulislah diagram sel volta yang dapat disusun dari ketiga elektrode tersebut.