
Tuliskan reaksi masingmasing setengah sel, reaksi sel, d...
Rangkaian Sel Volta: Kedua larutan dihubungkan oleh jembatan garam yang berisi KCl. Elektron mengalir dari elektroda Zn (sebagai anoda) ke elektroda Cu (sebagai katoda) melalui kawat eksternal. Setengah sel yang satu terdiri dari logam seng (zinc) yang dicelupkan ke dalam larutan dan setengah sel yang lainnya terdiri atas logam tembaga (copper.

PENYETARAAN REAKSI REDOKS DENGAN CARA SETENGAH REAKSI YouTube
Di dalam video ini, ko Ben akan membahas materi dan menjelaskan tentang soal soal yang biasanya diberikan dalam Kimia bab Redoks Lanjutan dengan detail. Jadi.

Diketahui reaksi setengah sel berikut.Anode Zn(s)>Zn^2+...
Share Tweet. Berikut kami sajikan 20 Contoh Soal dan Pembahasan Reaksi Redoks dan Elektrokimia: Soal No. 1. Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana asam) Cu (s) + HNO 3 (aq) → Cu (NO 3) 2 (aq) + NO (g) + H 2 O (l) Jawaban: Tahap 1, kita tentukan reaksi ionnya.

Penyetaraan reaksi redoks metode setengah reaksi suasana asam YouTube
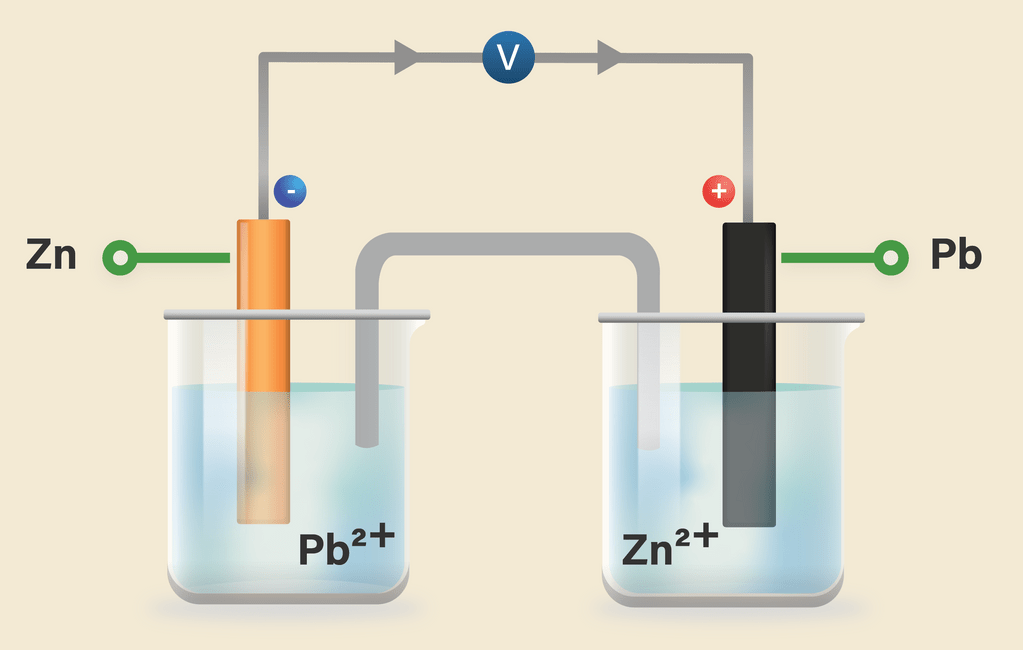
Pembacaan sebesar 0,460 V pada voltmeter menggambarkan voltase sel , yakni beda potensial diantara kedua setengah sel. Kita dapat membayangkan beda potensial atau voltase ini sebagai gaya pendorong elektron, dimana semakin besar beda potensialnya, maka semakin besar aliran elektron.

penyetaraan reaksi redoks metode setengah reaksi part 1 (langkahlangkah) YouTube
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.
Diketahui reaksi setengah sel berikut Zn 2
Contoh Perhitungan EMF. Perhatikan reaksi redoks: Mg (s) + 2 H + (aq) → Mg 2+ (aq) + H 2 (g) a) Hitung EMF sel untuk reaksi tersebut. b) Identifikasi apakah reaksinya galvanik. Larutan: Langkah 1: Pecahkan reaksi redoks menjadi setengah reaksi reduksi dan oksidasi . Ion hidrogen, H + mendapatkan elektron ketika membentuk gas hidrogen, H 2 .

Diagram Sel, Potensial Standar, dan Reaksi Sel ( SEL ELKETROKIMIA) KIMIA SMA YouTube
Setengah reaksi reduksi. : Cu2+(aq) + 2e− → Cu (s) Reaksi keseluruhan. : Zn (s) + Cu2+(aq) → Zn2+(aq) + Cu (s) Reaksi keseluruhan adalah jumlah dari kedua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi yang disebut reaksi redoks. Reaksi di atas menunjukkan terjadinya pelepasan dan pengikatan elektron, maka.

Diagram sel Volta, Potensial Sel,dan Reaksi Sel (ELEKTROKIMIA) KIMIA SMA YouTube
Contoh:Setarakan reaksi reaksi redoks yang berlangsung dalam suasana basa berikut.Bi 2 O 3 + ClO-→ BiO 3-+ Cl-Pecah reaksi menjadi 2 setengah reaksiPerhatikan atom-atom yang ada dalam reaksi. Selain atom H dan O, terdapat pula atom Bi dan Cl. Kumpulkan spesi-spesi pada setengah reaksi berdasarkan kesamaan atomnya (abaikan atom H dan O).

Penyetaraan reaksi redoks metode setengah reaksi (suasana asam) part 2 YouTube
A. Pilihlah 2 pasang reaksi setengah sel diatas yang memiliki nilai potensial elektroda yang paling besar ! B. lalu buatlah notasi selnya ! Jawab A : Untuk mencari 2 pasang reaksi setengah sel yang memiliki nilai potensial elektroda sel yang paling besar, maka carilah logam yang memiliki Eo yang paling positif sebagai katoda dan Eo yang paling negatif sebagai anoda.

Penyetaraan Reaksi Redoks Cara Setengah Reaksi YouTube
E 0 sel = potensial sel dalam kondisi standar R = konstanta gas, yaitu 8,31 (volt-coulomb)/(mol-K) T = suhu (K) n = jumlah mol elektron yang dipertukarkan dalam reaksi elektrokimia (mol) F = Konstanta Faraday, 96500 coulomb/mol Q = hasil bagi reaksi, yang merupakan persamaan kesetimbangan dengan konsentrasi awal dan bukan konsentrasi kesetimbangan

Contoh soal penyetaraan reaksi redoks metode setengah reaksi suasana asam
Prinsip kerja dari sel volta adalah dengan pemisahan dua bagian reaksi redoks, yakni setengah reaksi oksidasi di anoda dan setengah reaksi reduksi di katoda. Elektroda yang mengalami oksidasi akan menjadi Zn2+ yang masuk ke dalam larutan. Reduksi elektron yang terlepas ditangkap Cu2+ dari larutan, sehingga terbentuk endapan.

Perhitungan Potensial Sel dan Contoh Soal
E° sel = E° ox + E° red E° cell = -0,20 V + 1,33 V E° cell = +1,13 V. Langkah 3: Temukan konstanta kesetimbangan, K. Ketika reaksi berada pada kesetimbangan, perubahan energi bebas sama dengan nol. Perubahan energi bebas sel elektrokimia berhubungan dengan potensial sel dari persamaan: G = -nFE sel dimana G adalah energi bebas reaksi n.

Penyetaraan Reaksi Redoks Cara Setengah Reaksi dalam Suasana Basa YouTube
Sel Volta: Contoh Notasi, Reaksi Potensial Elektrode Standar, dan Deret Unsur | Kimia Kelas 12. March 17, 2023 by rahmi. Teman KOCO, tahukah kamu bahwa reaksi redoks spontan dapat digunakan sebagai sumber listrik. Nah, alat yang dapat mengubah reaksi kimia menjadi energi listrik disebut sel Volta atau sel Galvani.

Potensial Sel Untuk Jumlah Setengah Reaksi (Kimia SBMPTN, UN, SMA) YouTube
Energi listrik pada sel volta berasal dari pergerakan elektron dari reaksi redoks yang spontan. Contoh gambar sel volta digambarkan sebagai berikut. Sel volta tersusun atas 2 setengah sel yang dihubungkan dengan jembatan garam. Setengah sel terdiri dari elektroda (logam) dan elektrolitnya.

PPT 1). Cara setengah reaksi setiap persamaan reaksi redoks merupakan penjumlahan 2 setengah
Download Modul "Sel Volta" untuk Materi yang Lebih Lengkap dan Contoh Soal yang Lebih Banyak Di Sini. Pada gambar di atas, terlihat rangkaian sel volta dengan dua kompartemen. Masing-masing kompartemen merupakan setengah sel. Pada kompartemen kiri, dalam larutan ZnSO 4 terjadi setengah reaksi oksidasi Zn menjadi ion Zn 2+, sedangkan pada kompartemen kanan, dalam larutan CuSO 4 terjadi.

PENYETARAAN REAKSI REDOKS CARA ION ELEKTRON (SETENGAH REAKSI)/ SUASANA ASAM YouTube
Setengah-sel. Setengah-sel adalah suatu struktur (kompartemen) yang berisi elektrode konduktif dan lingkungan elektrolit konduktif yang dipisahkan oleh lapisan ganda Helmholtz yang terbentuk secara alami. [1] Reaksi kimia yang terjadi di lapisan ini secara cepat memompa muatan listrik antara elektrode dan elektrolit tersebut, menghasilkan.