Mengapa Cl Mempunyai Bermacammacam Bilangan Oksidasi? Urip dot Info
To calculate oxidation numbers of elements in the chemical compound, enter it's formula and click 'Calculate' (for example: Ca2+, HF2^-, Fe4 [Fe (CN)6]3, NH4NO3, so42-, ch3cooh, cuso4*5h2o ). The oxidation state of an atom is the charge of this atom after ionic approximation of its heteronuclear bonds. The oxidation number is synonymous with.

Contoh Soal 1 Penyetaraan Redoks Metode Perubahan Biloks YouTube
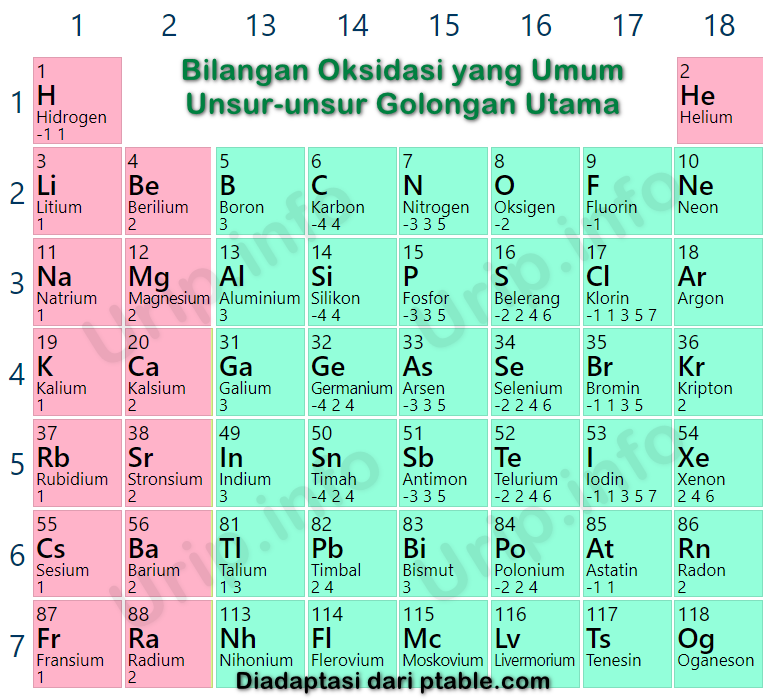
Konsep Peningkatan dan Penurunan Bilangan Oksidasi (Biloks) Reduksi Penurunan Biloks Oksidasi Peningkatan Biloks Cr2O72- + Fe2+ Cr3+ + Fe3+ +6 +2 +3 +3 Reduksi Oksidasi Penentuan Bilangan Oksidasi a.. dan pada senyawa superoksida seperti KO2, RbO2 biloks O yaitu -1/2 . Sementara itu, pada F2O biloks dari O yaitu +2 f. Jumlah total biloks.

Aturan penentuan biloks
Aturan penentuan biloks - Download as a PDF or view online for free. Submit Search. Upload.. Dalam senyawa superoksida bilangan oksidasinya adalah -1/2, seperti pada KO2 dan NaO2. g) Jumlah bilangan oksidasi untuk semua atom unsur dalam molekul atau senyawa adalah 0. Jumlah bilangan oksidasi untuk atom atau unsur pembentuk ion poliatom sama.

BILANGAN OKSIDASI (BILOKS) YouTube
Bilangan oksidasi atom F yaitu -1. Atom logam selalu mempunyai bilangan oksidasi positif dengan harga yang sesuai pada nomor golongannya, kecuali dengan logam transisi yang mempunyai biloks lebih dari satu. - Bilangan oksidasi Li, Na, K, Rb, dan Cs yaitu +1. - Bilangan oksidasi Be, Mg, Ca, Sr, Ba, dan Ra yaitu +2. - Bilangan oksidasi Al yaitu +3.

Konsep mudah menentukan biloks Kimia SMA YouTube
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Koof Unsur P x Biloks Unsur P + Koof Unsur NP x Biloks Unsur NP = 0 Agar sobat bisa lebih paham , silahkan sobat kerjakan contoh soal di bawah ini dengan menggunakan rumus-rumus diatas . Carilah biloks dari unsur-unsur yang terdapat di dalam senyawa ion berikut ini ! 1. Na dalam NaCl 6. Cr dalam CrCl3 2. Ag dalam AgBr 7. V dalam V2O5 3.

Kombucha KO2 (Bebida a Base de Té) 12oz Sabores Varios Amazonas Latin Market
Dan dalam senyawa superoksida, KO2, biloks H = - ½. d. Biloks unsur logam selalu bernilai positif. Contoh: Biloks unsur golongan IA (H, Li, Na, K, Rb, Cs, Fr) = +1. Biloks unsur golongan IIA (Be, Mg, Ca, Sr, Ba, Ra) = +2.. Jumlah biloks dalam ion poliatomik, contoh PO43- = muatannya = -3 g. Biloks ion tunggal, contoh Na+ = muatannya = +1.

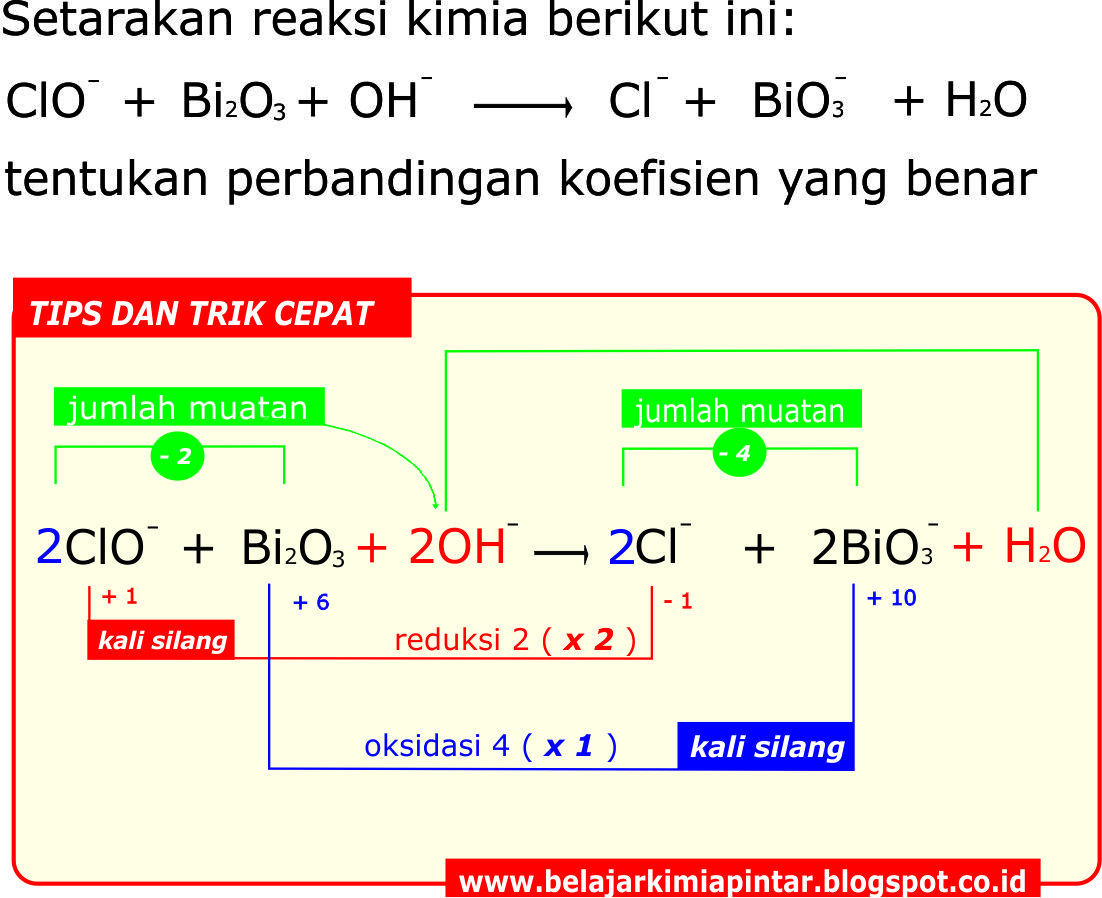
Penyetaraan Reaksi Redoks dengan Cara Biloks
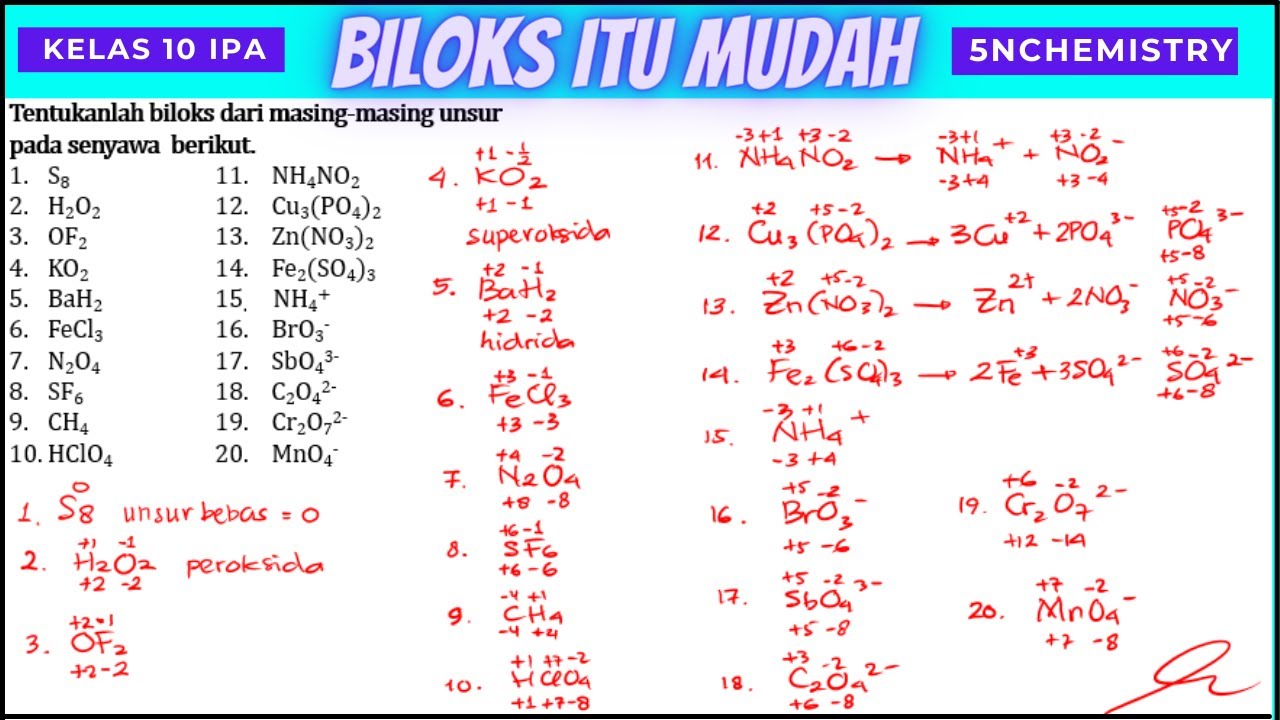
Cth: SO4^2- biloks = -2. 4 O = 4x(-2) = -8. S = +6. SO4^2- = 6-8 = -2 . Senyawa AgNO3 dan AgCl memiliki biloks total = 0, sehingga perhitungan biloks Ag pada senyawa-senyawa tersebut adalah sebagai berikut: Biloks AgNO3 = biloks Ag + biloks N + (3x biloks O) 0 = biloks Ag + (+5) +(3x-2) 0 = biloks Ag + 5 - 6. Biloks Ag = +1 . Biloks AgCl.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
4) Oksigen memiliki biloks = -2, kecuali: • Dalam senyawa peroksida biloks O = -1. contoh dalam H2O2 dan Na2O2. • Dalam senyawa super peroksida biloks O = -½. contoh dalam KO2. 5) Bilangan oksidasi suatu senyawa = 0. 6) Bilangan oksidasi suatu ion = muatannya. 7) Unsur halogen sebagai halida memiliki biloks = -1. contoh: NaCl, MgCl2 dan KI.

PENYETARAAN REDOKS DENGAN CARA BILOKS UNTUK REAKSI ION (Part 1) YouTube
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.

biloks Cu biloks kimia kelas X YouTube
Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation.

Cara Menentukan Biloks Berdasarkan Prioritas YouTube
Bilangan oksidasi dapat disebut juga dengan biloks. Dalam reaksi redoks, bilangan oksidasi digunakan untuk menentukan hasil reduksi dan hasil oksidasi dari suatu atom dan senyawa.. Dalam KO2, bilangan oksidasi O adalah -½ . Dalam F2O, bilangan oksidasi O adalah +2. Dalam peroksida ( H2O2,Na2O2, dan BaO2), bilangan oksidasi O adalah -1..

Cara menentukan Biloks ( Bilangan Oksidasi ) Reaksi Redoks YouTube
Potassium superoxide is an inorganic compound with the formula K O 2. [6] It is a yellow paramagnetic solid that decomposes in moist air. It is a rare example of a stable salt of the superoxide anion. It is used as a CO2 scrubber, H2O dehumidifier, and O2 generator in rebreathers, spacecraft, submarines, and spacesuits .

3 Contoh Soal Bilangan Oksidasi (Biloks) YouTube
1. biloks dari Na2,KO2,Ocl2; 2. 1.tentukan biloks O dalam MgO22.tentukan biloks O dalam KO2 3. 1. Biloks O dalam BaO 2. Biloks O dalam KO2 3. Biloks O dalam MgO Termasuk senyawa dan alasannya; 4. tentukan: •biloks CI dalam KCIO2 •biloks C dalam H2CO3 •biloks S dalam SO42- •biloks N dalam NH4+ 5.

PENENTUAN BILANGAN OKSIDASI (BILOKS). YouTube
Biloks senyawa superoksida, seperti KO2 dan NaO2, bernilai = -½ . Bilangan oksidasi (Biloks) unsur O dalam H2O, KOH, H2SO4 dan Na3PO4 bernilai = -2 Jumlah pada bilangan oksidasi (Biloks) unsur-unsur pada senyawa adalah 0 (nol).
Trik Penyetaraan Reaksi Redoks Cara Biloks ( Suasana Basa ) KIMIA OKE PINTAR
Biloks oksigen dalam senyawanya adalah -2, kecuali saat berada dalam senyawa peroksida biloksnya -1. 7. Jumlah bilangan oksidasi molekul sama dengan jumlah muatannya. Pada senyawa K₂O, bilangan oksidasi O telah diketahui sebesar -2 berdasarkan aturan penentuan bilangan oksidasi. Biloks K dapat ditentukan menggunakan cara berikut: Biloks K₂O.