
Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Teori Asam Basa Bronsted Lowry YouTube
Pengertian basa menurut teori asam basa bronsted-lowry adalah zat atau spesi (ion/molekul) yang menjadi penerima proton (akseptor H+ atau penerima hidrogen). Teori Bronsted-Lowry bisa digunakan saat menjelaskan sifat dari asam basa dengan menggunakan berbagai macam pelarut, tidak hanya air (H2O). Jadi bisa dituliskan bahwa: Asam = donor H+ Basa.

Kimia Sma Asam Basa Bronsted Lowry Menentukan Asam Atau Basa Suatu Sexiz Pix
Konsep asam-basa menurut Bronsted-Lowry adalah konsep yang lebih luas daripada konsep Arrhenius. Menurut konsep Bronsted-Lowry, asam adalah zat yang dapat melepaskan proton (H+) dan basa adalah zat yang dapat menerima proton (H+). Konsep ini digunakan untuk menjelaskan sifat asam-basa dalam larutan non-air, seperti dalam larutan amonia atau.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
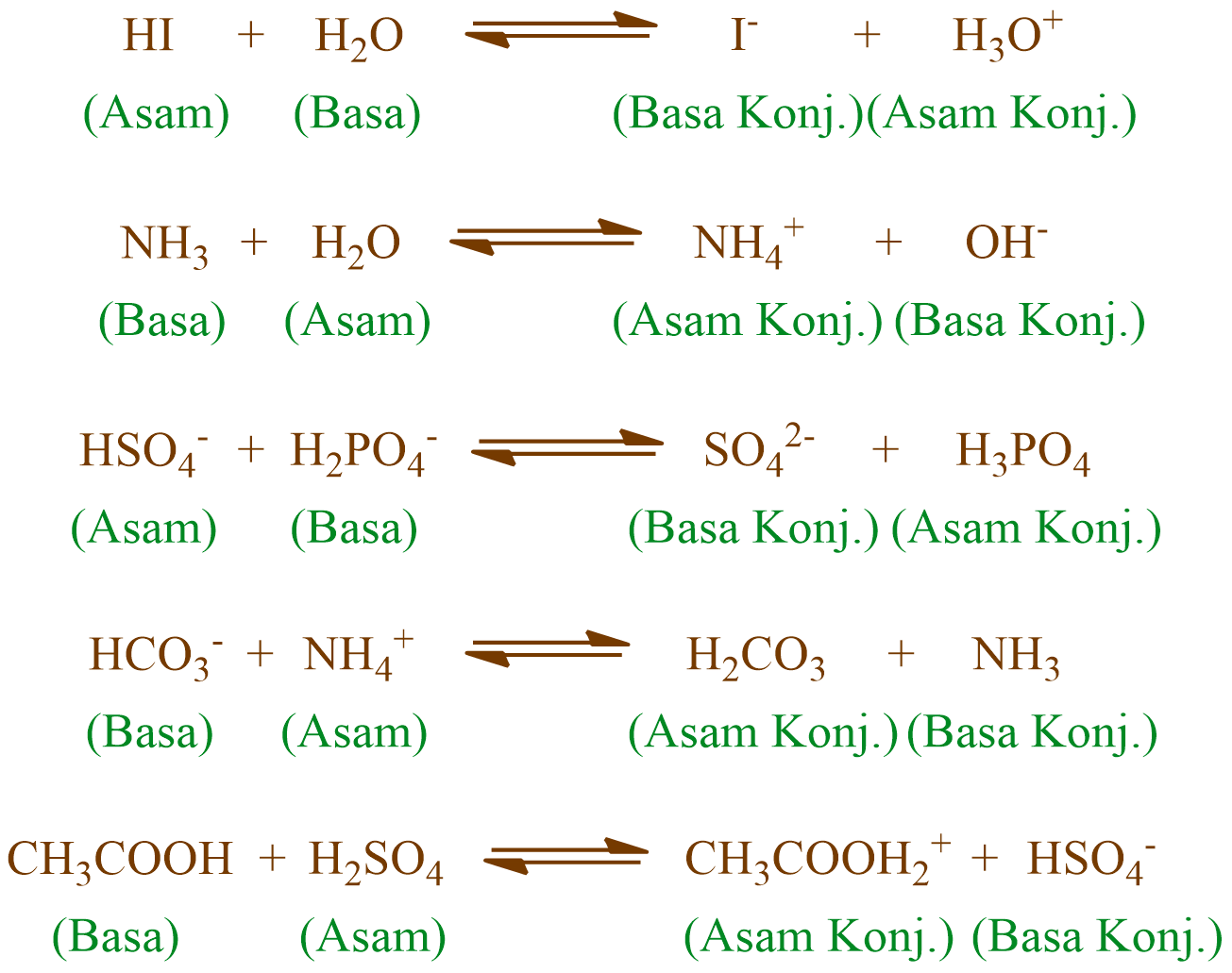
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori Asam Basa Bronsted-Lowry dikemukakan oleh Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923. Teori ini dapat menjawab kekurangan yang terdapat pada teori Arhennius. Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry.

Teori Asambasa BronstedLowry YouTube
Contoh Mengidentifikasi Asam dan Basa Bronsted Lowry. Tidak seperti asam dan basa Arrehenius, pasangan asam basa Bronsted Lowry bisa terbentuk tanpa adanya reaksi di dalam larutan berair. Sebagai contoh, amonia dan juga hidrogen klorida bisa bereaksi membentuk amonium klorida padat menurut beberapa reaksi seperti berikut: NH3(g) + HCl(g) →.

Teori Asam basa brownsted lowry Teori AsamBasa BronstedLowry Pada tahun 1923, ahli kimia
50. Rangkuman 1 Teori Asam-Basa Bronsted-Lowry. Rangkuman 2 Teori Asam-Basa Bronsted-Lowry. Rangkuman 3 Teori Asam-Basa Bronsted-Lowry. Kuis Akhir Teori Asam-Basa Bronsted-Lowry. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
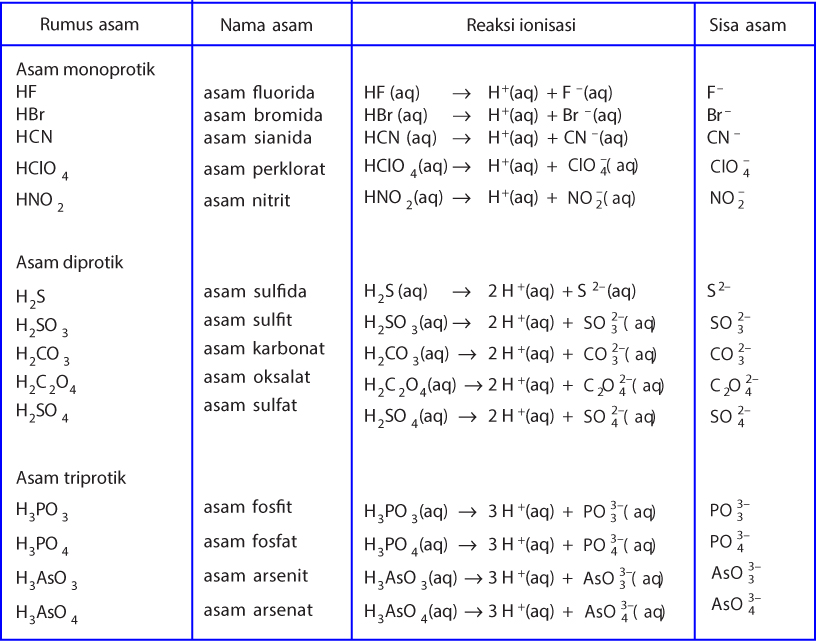
Jadi, menurut definisi asam basa Brønsted-Lowry, asam adalah donor proton. basa adalah akseptor proton. Jika ditinjau dengan teori Brønsted-Lowry, pada reaksi ionisasi HCl ketika dilarutkan dalam air, HCl berperan sebagai asam dan H 2 O sebagai basa. HCl(aq) + H 2 O(l) → Cl − (aq) + H 3 O + (aq)

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Teori Asam Basa Bronsted Lowry
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Teori Asam Basa Arrheniuss, BronstedLowry,
Dalam teori asam basa Bronsted Lowry tidak ada zat yang bersifat netral. Menurut Bronsted Lowry, setiap zat akan bersifat asam atau basa bergantung apakah ia menerima atau melepaskan proton ion (H + ). Selain itu, teori asam basa Bronsted Lowry bersifat luas, tidak hanya bergantung pada pelepasan ion H + atau OH +, misalnya senyawa NH 2-.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Teori Bronsted-Lowry Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H+). Menurut konsep Bronsted dan Lowry: Asam adalah zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain.

Mudah😆 !! Pasangan AsamBasa menurut Teori Bronsted Lowry YouTube
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).
Menurut Konsep Asam Basa Bronsted Lowry mari semua dansa denganku lirik
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).