
Menentukan Asam Basa Konjugat BronstedLowry YouTube
50. Rangkuman 1 Teori Asam-Basa Bronsted-Lowry. Rangkuman 2 Teori Asam-Basa Bronsted-Lowry. Rangkuman 3 Teori Asam-Basa Bronsted-Lowry. Kuis Akhir Teori Asam-Basa Bronsted-Lowry. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru.

Teori Asam Basa Bronsted Lowry YouTube
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Dalam teori asam basa yang dicetuskan oleh Bronsted dan Lowry, ada istilah berupa asam basa konjugasi dimana asam konjugasi tersebut adalah senyawa yang ada pada bagian kanan maupun reaksi yang mendapatkan tambahan dari satu atom hidrogen dari reaktan. Sedangkan yang dimaksud dengan basa konjugasi merupakan senyawa yang ada pada bagian kanan.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Perhatikan reaksi berikut.NH3 + H2O NH4+ + OH-Menurut konsep Bronsted-Lowry, yang bertindak sebagai pasangan asam basa konjugasi adalah….

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
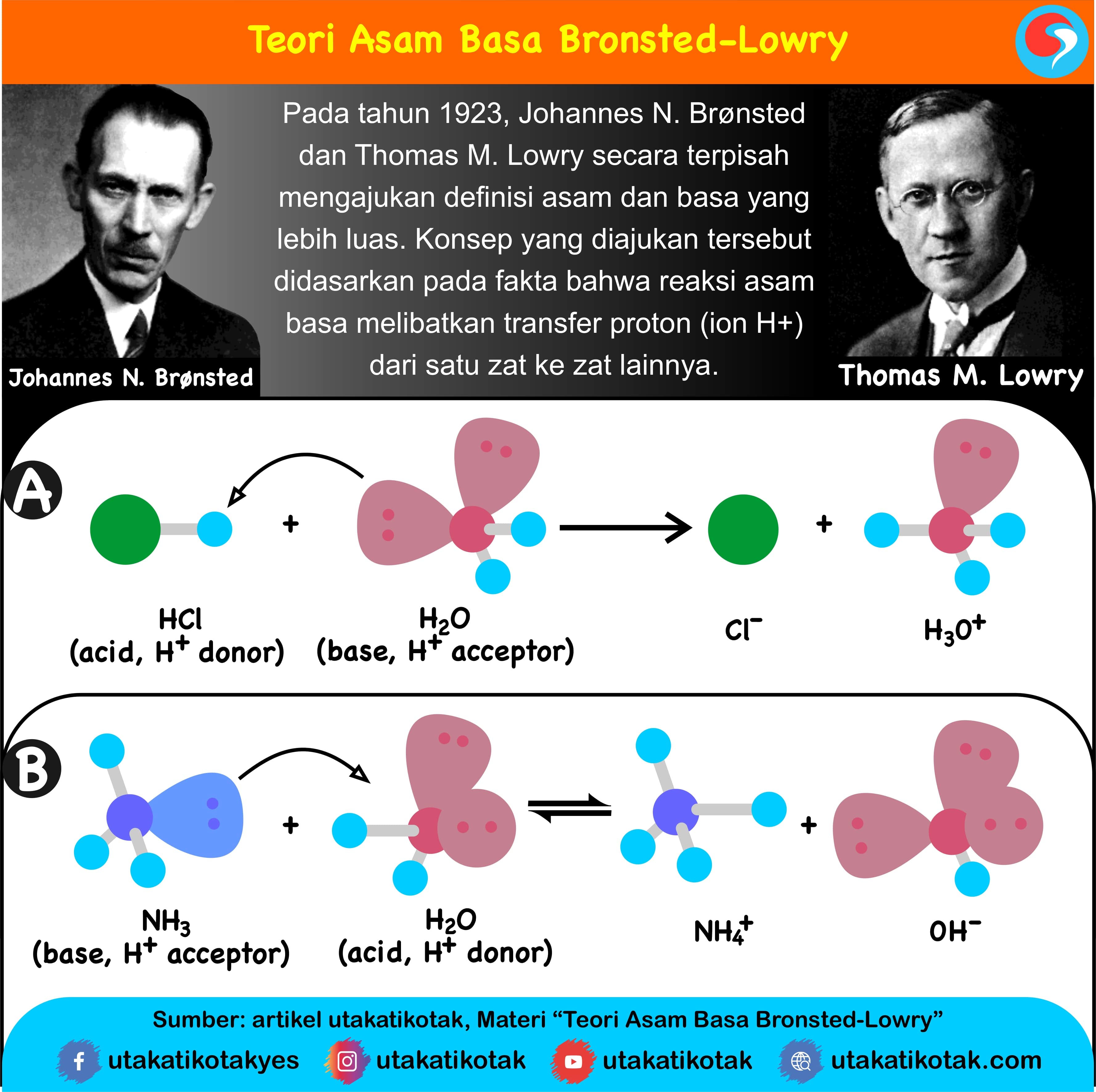
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.
Teori Asam dan Basa Menurut BronstedLowry
Menurut Bronsted Lowry asam adalah spesies apa pun yang menyumbangkan proton (H+). Dilansir dari Chemistry LibreTexts, asam yang kehilangan proton berubah menjadi basa konjugasinya. Misalnya, senyawa asam Bronsted HF yang direaksikan dengan air dengan reaksi berikut: HF (aq) + H2O (l) → F- (aq) + H2O+ (aq). Dalam reaksi tersebut, proton dari.

Tulislah persamaan reaksi asam basa dibawah ini menurut bronsted lowry dan tentukan pasangan
Konsep mudah belajar teori asam basa Bronsted-Lowry . dimana asam adalah pemberi proton . sedangkan Basa adalah penerima proton. terdiri dari asam basa konj.

Teori Asam Basa
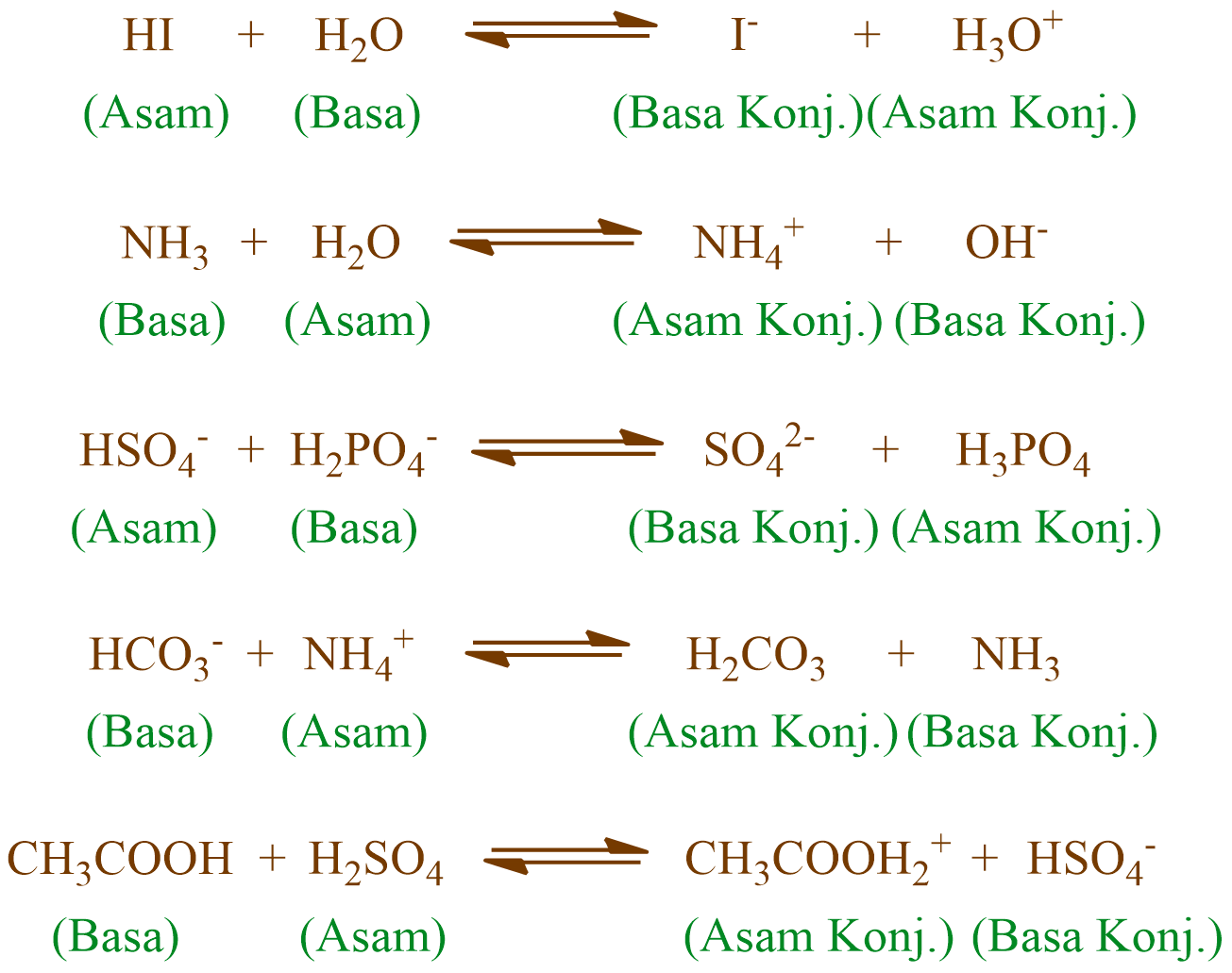
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Asam = donor H+. Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20.

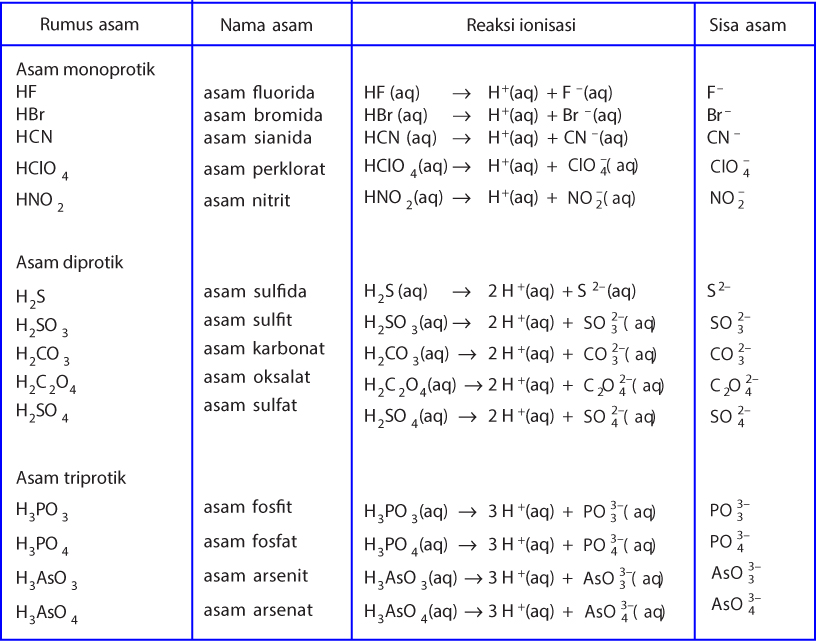
Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Menurut Brønsted-Lowry, basa adalah spesi yang bertindak sebagai penerima (akseptor) proton. 1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Teori Bronsted-Lowry. Muncul konsep asam basa menurut para ahli lain pada 1923, J.N Bronsted dari Denmark dan T.M Lowry dari Inggris secara terpisah dalam waktu yang bersamaan mengajukan konsep yang serupa, yakni:. Tentukanlah spesi yang akan bertindak sebagai asam, basa, serta asam dan basa konjugasi dari reaksi menyeluruh antara asam.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Sedangkan basa yang telah menerima atau menangkap proton dari asam, disebut sebagai asam konjugasi. Dan keduanya disebut dengan pasangan asam basa konjugasi. Asam: H 2 O Basa: NH 3 Asam konjugasi: NH 4 + Basa konjugasi: OH - Jadi, dapat disimpulkanjawaban asam basa konjugasi yang tepat adalah H 2 O dan OH - kemudian NH 3 dan NH 4 + .

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.