Life Is Beautiful Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik???
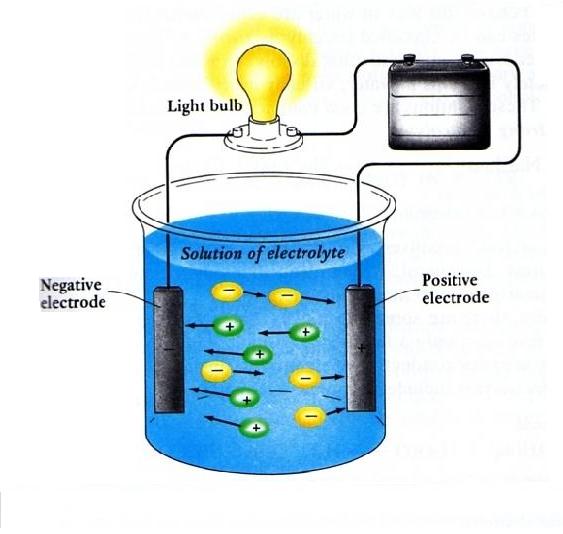
Larutan elektrolit dapat menghantarkan arus listrik karena larutan elektrolit adalah larutan yang mengandung zat-zat yang dapat terionisasi atau terdisosiasi menjadi ion-ion positif dan negatif. Ion-ion ini dapat bergerak bebas dalam larutan dan membentuk arus listrik. Contoh larutan elektrolit adalah larutan garam, asam, basa, dan beberapa.

Larutan H_(2) SO_(4) dapat menghantarkan listrik karena...
1. Larutan elektrolit mengandung ion yang dapat bergerak, memungkinkan energi listrik untuk dikirimkan. 2. Larutan elektrolit berfungsi sebagai sumber daya dan konduktor untuk menghantarkan arus listrik. 3. Larutan elektrolit dapat digunakan untuk menghasilkan energi listrik, misalnya dalam baterai. 4.

pratikum laporan pratikum tentang daya hantar listrik dalam larutan
Demikianlah jawaban mengapa suatu larutan dapat menghantarkan listrik. Larutan mengandung ion-ion yang dapat menarik muatan listrik, menghasilkan reaksi kimia, dan memiliki tingkat konduktivitas listrik yang tepat. Jadi, dengan berbagai alasan yang ditunjukkan di atas, dapat dikatakan bahwa suatu larutan dapat dengan mudah menghantarkan listrik.

Suatu Larutan Dapat Menghantarkan Arus Listrik Apabila Mengandung YPHA.OR.ID
Rangkuman: Penjelasan Lengkap: mengapa larutan elektrolit mampu menghantarkan arus listrik. 1. Larutan elektrolit mampu menghantarkan arus listrik karena adanya ion-ion yang bergerak di dalamnya. 2. Konduktivitas tinggi larutan elektrolit memungkinkan arus listrik mengalir. 3.

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
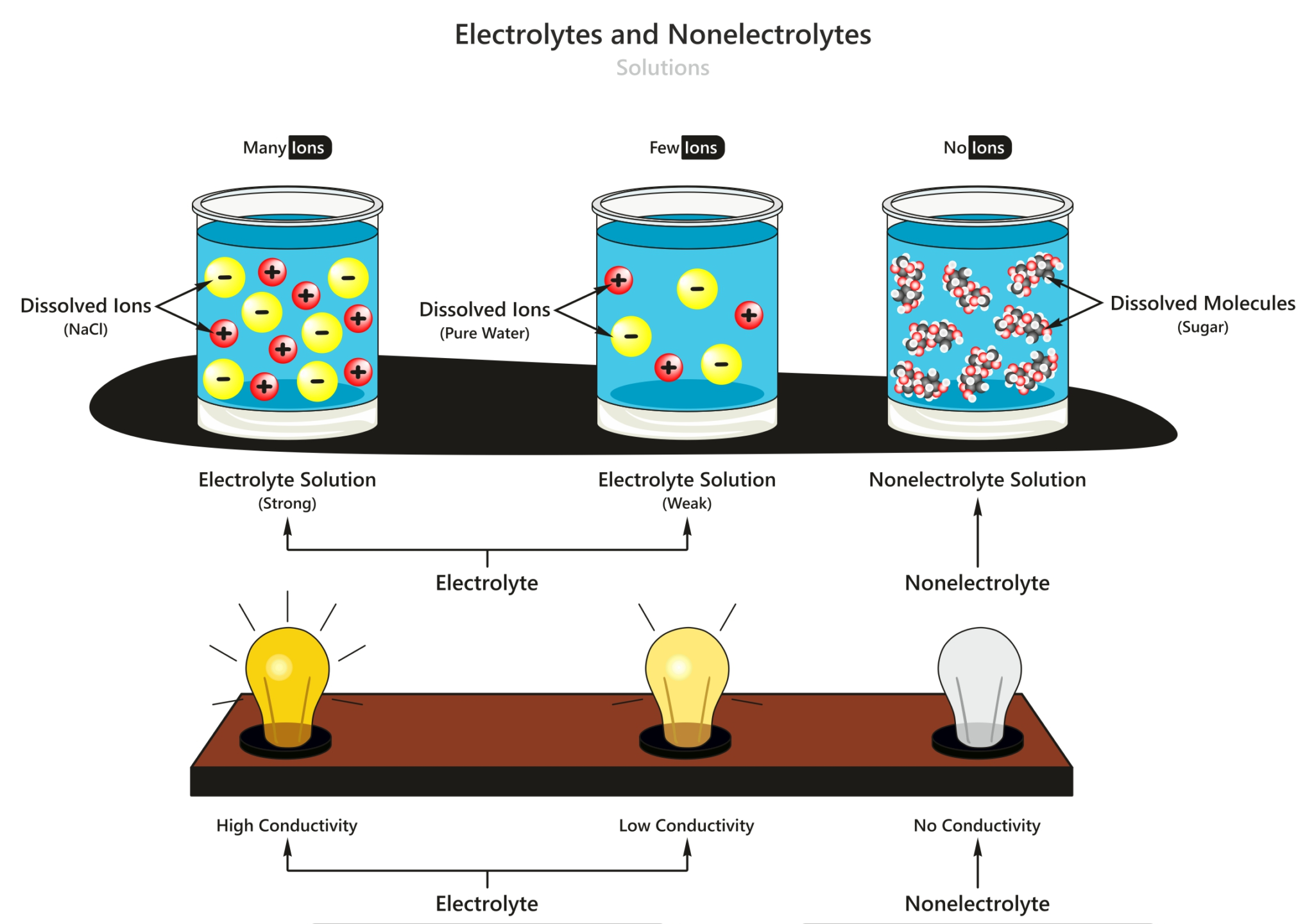
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi. Baca juga.

Penyebab Larutan Elektrolit dapat Menghantarkan Listrik Sch
Air garam bisa menghantarkan arus listrik karena dalam larutan tersebut terdapat ion-ion yang bebas bergerak dan membawa muatan listrik. Ion-ion tersebut berasal dari garam dapur yang terurai menjadi ion natrium dan ion klorida ketika dilarutkan dalam air. Ion-ion tersebut disebut elektrolit. Proses penghantaran arus listrik oleh air garam.
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Logam dapat menghantarkan listrik sebab adanya elektron yang dapat bergerak bebas. Aliran listrik sendiri adalah aliran elektron yang bergerak dari potensial tinggi ke potensial rendah. Sifat daya hantar listrik pada logam ini dapat dijelaskan melalui teori lautan elektron, yaitu sebagai berikut.

Larutan yang menghantarkan listrik dengan baik mengandung...
Sehingga, ion dapat bergerak bebas di dalam larutan elektrolit. Ion-ion yang bergerak bebas itulah yang menjadi kunci mengapa larutan elektrolit dapat menghantarkan listrik. Ketika larutan elektrolit di aliri listrik, muatan listrik akan di bawa oleh ion. Ion-ion akan bergerak bebas sembari membawa muatan listrik, mengakibatkan arus listrik.

Bahan berikut yang dapat menghantarkan listrik melalui pe...
Hal inilah yang menyebabkan larutan nonelektrolit tidak dapat menghantarkan listrik. Dari penjelasan di atas, maka dapat disimpulkan sebagai berikut. Larutan elektrolit dapat menghantarkan arus listrik karena zat elektrolit dalam larutannya terurai menjadi ion-ion bermuatan listrik dan ion-ion tersebut selalu bergerak bebas.

Pasangan Larutan Berikut Yang Dapat Menghantarkan Arus Listrik Adalah YPHA.OR.ID
Elektrolit adalah larutan yang diketahui dapat menghantarkan arus listrik. Hal tersebut dikarenakan larutan mengandung beberapa ion dan zat senyawa kimia lainnya. Namun larutan ini memiliki 2 jenis yaitu larutan elektrolit kuat dan lemah. Jika dicampur dengan zat pelarut, senyawa tersebut akan menempel pada elektroda yang membantu menghasilkan.
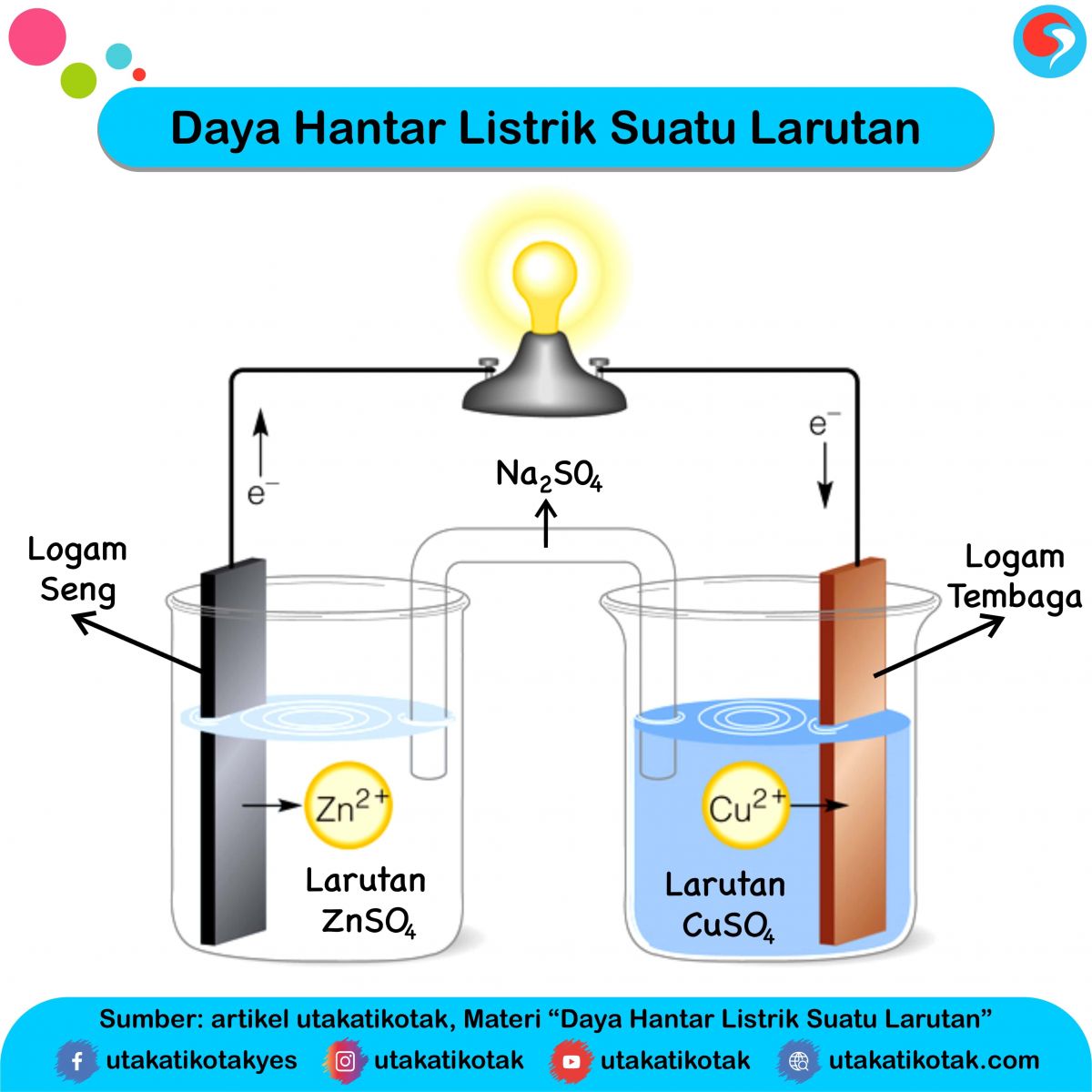
Daya Hantar Listrik Suatu Larutan
Contoh elektrolit kuat adalah asam sulfat (air aki) dan natrium klorida (garam dapur). Larutan elektrolit lemah, merupakan elektrolit yang punya kekuatan daya hantar listrik lemah, hal ini disebabkan karena hanya sebagian kecil molekulnya saja yang terurai menjadi ion-ion. Nilai α pada larutan ini berada diantara 0 dan 1 (0 < α < 1).

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Tidak adanya aliran muatan dari pergerakan ion-ion, menyebabkan larutan yang mengandung non elektrolit tidak dapat menghantarkan listrik. 3. Di bawah ini yang dapat menghantarkan listrik paling baik adalah.. a. Air suling b. Air laut c. Air gula . Oke mari kita bahas satu per satu dari ketiga pilihan jawaban di atas.

Cara Larutan Elektrolit Menghantarkan Arus Listrik
Larutan NaCl dapat menghantarkan arus listrik, sehingga termasuk dalam larutan elektrolit. Larutan elektrolit dapat menghantarkan arus listrik karena zat elektrolit dalam larutannya terurai menjadi ion-ion bermuatan listrik dan ion-ion tersebut selalu bergerak bebas. Larutan NaCl dapat terurai menjadi ion-ionnya dalam larutan. NaCl → Na+ +Cl−.

Mari bertanya! Tanya MIPI
Apa yang menyebabkan suatu larutan dapat menghantarkan listrik Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya | Kimia Kelas 10 Rabia Edra Jan 14, 2022 • 6 min read

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Larutan Non-Elektrolit. Larutan Non-elektrolit adalah larutan yang tidak dapat membentuk ion-ion dalam pelarutnya sehingga tidak dapat menghantarkan listrik. Ciri dari larutan ini ketika dilakukan percobaan adalah tidak dapat menyalakan lampu dan tidak menghasilkan gas pada kedua elektrodenya.

Pasangan larutan berikut yang dapat menghantarkan arus li...
Larutan sukrosa dianggap sebagai larutan non elektrolit karena molekul sukrosa tidak mengalami disosiasi ionik dalam larutan. Molekul sukrosa tetap utuh dan tidak memisahkan diri menjadi ion-positif dan ion-negatif, sehingga tidak dapat menghantarkan arus listrik. Soal 4. Apa yang membedakan antara larutan elektrolit kuat dan elektrolit lemah?